Вечность. В поисках окончательной теории времени, стр. 50
В частности, было бы очень странно, если бы она внезапно уменьшилась. Стрела времени появляется потому, что система (или Вселенная) с течением времени естественным образом переходит от редких конфигураций к более общим.
Все это на первый взгляд кажется весьма правдоподобным, и в конечном итоге мы убедимся, что это действительно так. Но в ходе наших рассуждений мы сделали несколько «обоснованных» логических скачков, заслуживающих более тщательного рассмотрения. В оставшихся разделах этой главы мы прольем свет на различные предположения, которые необходимо сделать для больцмановской интерпретации энтропии, и попробуем решить, насколько они оправданны.
Полезная и бесполезная энергия
У нашего примера с контейнером газа есть интересная особенность: стрела времени там — явление временное. После того как концентрация газа выравнивается (примерно в момент времени t = 150 на рис. 8.3), ничего больше не происходит. Отдельные молекулы продолжают перелетать из левой половины в правую и обратно, но число таких молекул взаимно компенсируется, и большую часть времени количество молекул слева и справа будет одинаково. Это конфигурации, соответствующие наибольшему числу расстановок отдельных молекул, в которых система соответственно обладает наибольшей энтропией.
Система, обладающая максимально возможной энтропией, находится в равновесии. Когда наступает состояние равновесия, системе становится некуда двигаться дальше; такая конфигурация для нее наиболее естественна. В равновесной системе стрела времени отсутствует, так как энтропия не увеличивается (и не уменьшается). Для макроскопического наблюдателя система в равновесии предстает статичной, не меняющейся.
Ричард Фейнман в своей лекции «Характер физических законов» рассказывает историю, иллюстрирующую концепцию равновесия. [134] Представьте себе, что вы сидите на пляже и внезапно на вас обрушивается ливень. Вы принесли с собой полотенце, но пока вы успеваете добежать до укрытия, оно также промокает. Оказавшись под крышей, вы начинаете вытираться полотенцем. Какое-то время это работает, потому что полотенце промокло чуть меньше, чем вы. Тем не менее вскоре вы обнаруживаете, что оно пропиталось влагой и вы, вытираясь им, настолько же быстро смачиваете свою кожу, насколько быстро стираете с нее капли воды. Вы с полотенцем достигли состояния «равновесия влажности», и оно уже не может высушить вас. Это состояние, в котором число способов разместить молекулы воды на вас и на вашем полотенце максимально. [135]
После достижения состояния равновесия полотенце становится непригодным для достижения первоначальной цели (обсушиться). Обратите внимание, что когда вы вытираетесь, полный объем воды не меняется — она просто переходит с вас на полотенце. Аналогично, в контейнере с газом, изолированном от внешнего мира, полная энергия не меняется; она остается постоянной, по крайней мере в ситуациях, когда расширением пространства можно пренебречь. Однако энергия может быть распределена так, чтобы приносить какую-то пользу, а может быть и бесполезной. Когда энергия находится в конфигурации с низкой энтрпией, ее можно использовать для совершения работы. Но тот же объем энергии в состоянии равновесия абсолютно бесполезен. Энтропия — это также мера бесполезности конфигурации энергии. [136]
Снова вернемся к нашему контейнеру с перегородкой. Но на этот раз пусть это будет не перегородка с отверстием, жестко зафиксированная внутри контейнера и лишь позволяющая некоторой части молекул пролетать из одной его половины в другую, а сплошная подвижная пластина, прикрепленная к стержню, выходящему за пределы контейнера. То, что мы сейчас описали, — всего лишь обыкновенный поршень, с помощью которого при определенных обстоятельствах можно производить работу.
На рис. 8.4 показаны две разные ситуации, в которых может оказаться наш поршень. Вверху проиллюстрирована конфигурация с низкой энтропией: все молекулы газа находятся с одной стороны от перегородки. Внизу изображена ситуация с высокой энтропией: с обеих сторон от перегородки находятся равные объемы газа. Полное количество молекул и полная энергия одинаковы в обоих случаях; отличается только энтропия. Также очевидно, что развиваться события в этих двух случаях будут совершенно по-другому. В случае, представленном в верхней части рисунка, весь газ находится с левой стороны от поршня. Сила молекул, ударяющихся о перегородку, оказывает давление, которое выталкивает поршень до тех пор, пока газ не заполнит весь объем контейнера. Подвижный стержень поршня можно использовать для выполнения полезной работы, например кручения маховика (по крайней мере, в течение какого-то небольшого промежутка времени). При этом расходуется энергия газа, поэтому в конце процесса его температура станет ниже. (Поршни в двигателе вашего автомобиля работают точно так же, расширяя и охлаждая горячие газы — продукты сгорания паров бензина; эта полезная работа и приводит автомобиль в движение.)
В нижней части рисунка показан процесс, в котором первоначальная энергия такая же, но энтропия намного выше: по обеим сторонам перегородки находится одинаковое количество частиц. Высокая энтропия подразумевает равновесие, что, в свою очередь, свидетельствует о бесполезности энергии. И действительно, мы видим, что поршень не движется. Давление газа с одной стороны перегородки компенсируется давлением с другой стороны. Полная энергия газа в этом контейнере равна полной энергии в контейнере, изображенном в левом верхнем углу, однако в данном случае мы не можем воспользоваться ею в своих целях, например заставить газ передвинуть поршень и помочь нам сделать что-то полезное.
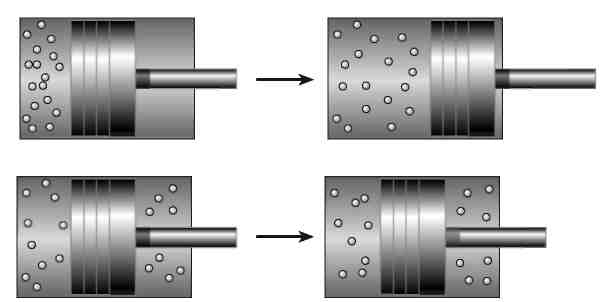
Рис. 8.4. Газ в разделенном сплошной перегородкой контейнере, применяемый для приведения в движение поршня. Вверху газ в состоянии с низкой энтропией выталкивает поршень вправо, производя полезную работу. Внизу газ в состоянии с высокой энтропией никак не влияет на положение поршня.
Этот пример помогает нам понять связь между взглядом Больцмана на энтропию и мнением Рудольфа Клаузиуса, который впервые сформулировал второе начало термодинамики. Вспомните, что Клаузиус и его предшественники вообще не думали об энтропии в терминах атомов, они рассматривали ее как независимую субстанцию с собственной динамикой. В исходной версии второго начала термодинамики энтропия даже не упоминалась; это было всего лишь утверждение о том, что «теплота не может спонтанно начать течь от более холодного объекта к более горячему». Когда контактируют два объекта с разной температурой, их температуры постепенно изменяются по направлению к некоторому равновесному значению между ними. Если же в контакте находятся два объекта с одинаковой температурой, то с ними ничего не происходит (так как они уже находятся в температурном равновесии).
С точки зрения физики атомов все это также имеет смысл. Возьмем классический пример соприкосновения двух объектов с разной температурой: кубик льда в стакане теплой воды (о котором мы говорили в конце прошлой главы). И кубик льда, и жидкость состоят из совершенно одинаковых молекул, а именно H2O. Единственное различие заключается в том, что температура льда намного ниже. Как мы уже говорили выше, температура — это мера средней энергии движения молекул в веществе. Таким образом, молекулы жидкой воды двигаются относительно быстро, а молекулы льда — медленно.
Однако такой тип условий — два набора молекул, в одном из которых молекулы движутся быстро, а в другом медленно, концептуально почти не отличается от двух наборов молекул, заключенных в контейнере по разные стороны от перегородки. В любом случае присутствуют макроскопические ограничения на перестановки микроскопических частей этих систем. Если бы у нас был только стакан воды, имеющей постоянную температуру, мы могли бы заменять молекулы в одной части стакана молекулами из какой-то другой его части, и с макроскопической точки зрения никаких различий при этом мы бы не увидели. Но если в воде плавает кубик льда, то нельзя запросто поменять местами молекулы льда и молекулы обычной воды — при этом кубик льда начал бы двигаться, и мы заметили бы это даже со своей макроскопической точки зрения. Деление молекул воды на «жидкость» и «лед» накладывает серьезные ограничения на число доступных перестановок, поэтому данная конфигурация обладает низкой энтропией. По мере того как температура молекул воды, составлявших в начале эксперимента ледяной кубик, и температура «жидкой» воды в стакане выравниваются, энтропия возрастает. Правило Клаузиуса о тенденции к выравниванию температур и о том, что теплота не может спонтанно течь от холодного объекта к горячему, абсолютно эквивалентно утверждению, что энтропия, как ее определил Больцман, в замкнутой системе никогда не уменьшается.
