Абсолютный минимум. Как квантовая теория объясняет наш мир, стр. 71
Углеродные кольца с делокализованными ?-связями входят во многие молекулы. Примером может служить нафталин, изображённый на рис. 18.7. Нафталин содержит десять атомов углерода, образующих два кольца по шесть атомов, к которым присоединены восемь атомов водорода. Две окружности изображают делокализованные молекулярные ?-орбитали. Как и бензол, нафталин является плоским, а каждый атом углерода в нём имеет полторы связи с соседними атомами углерода.
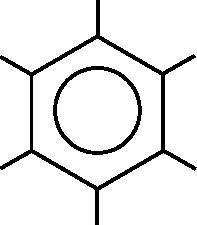
Рис. 18.6. Молекулярная диаграмма бензола. В каждой вершине находится атом углерода, а атомы водорода располагаются на свободных концах отрезков, отходящих от углерода. В виде окружности изображены делокализованные молекулярные ?-орбитали
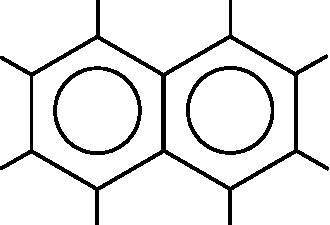
Рис. 18.7. Молекулярная диаграмма нафталина. Нафталин содержит десять атомов углерода и восемь атомов водорода. Окружности изображают делокализованные молекулярные ?-орбитали
Бензольные делокализованные молекулярные пи-орбитали
Бензол, нафталин и другие подобные молекулы называют ароматическими. Обычно они имеют приятный аромат. Нафталин используется против моли и имеет характерный запах. Духи содержат более сложные ароматические молекулы, в которые входит множество бензолоподобных колец, а также другие химические группы вместо атомов водорода. Небольшие изменения в молекулярной структуре приводят к изменению аромата, и именно поэтому разные духи пахнут по-разному.
В главе 8 мы обсуждали задачу о частице в ящике. На рис. 8.4 и 8.6 изображены волновые функции и энергетические уровни частицы в ящике. Волновая функция, связанная с низшим энергетическим уровнем, не имеет узлов. На следующем энергетическом уровне волновая функция имеет один узел, на следующем — два узла и т. д. Узел — это место, где волновая функция обращается в нуль, то есть вероятность обнаружить электрон равна нулю. Частица в ящике — это одномерная задача. Узел является точкой. В главе 10 мы анализировали волновые функции и энергетические уровни атома водорода. На рис. 10.2 и 10.6 изображены волновые функции атома водорода для состояний 1s, 2s и 3s. Эти волновые функции трёхмерные. Низшее энергетическое состояние (1s) не имеет узлов, следующее по энергии состояние (2s) имеет волновую функцию с одним узлом. Ещё более высокое энергетическое состояние (3s) имеет два узла. Эти узлы представляют собой трёхмерные поверхности, на которых вероятность обнаружения электрона равна нулю.
У бензольных ?-МО число узлов также возрастает с увеличением энергии. На рис. 18.8 схематически изображены бензольные ?-МО. Серым тоном показаны области высокой электронной плотности (высокой вероятности обнаружения электронов) для ?-МО.
Эти трёхмерные электронные облака продолжаются над плоскостью страницы и за ней и не имеют чётких границ. Также показаны энергетические уровни шести pz-электронов, которые заполняют связывающие МО с наименьшей энергией. МО с минимальной энергией не имеет узлов. Имеются два состояния со следующей по величине энергией. Обе такие МО имеют по одному узлу. Три МО без узлов и с одним узлом являются связывающими. Есть также два уровня со следующим по величине значением энергии. Эти МО имеют по два узла. МО с наивысшей энергией имеет три узла. Эти три МО, имеющие по два и три узла, являются разрыхляющими.
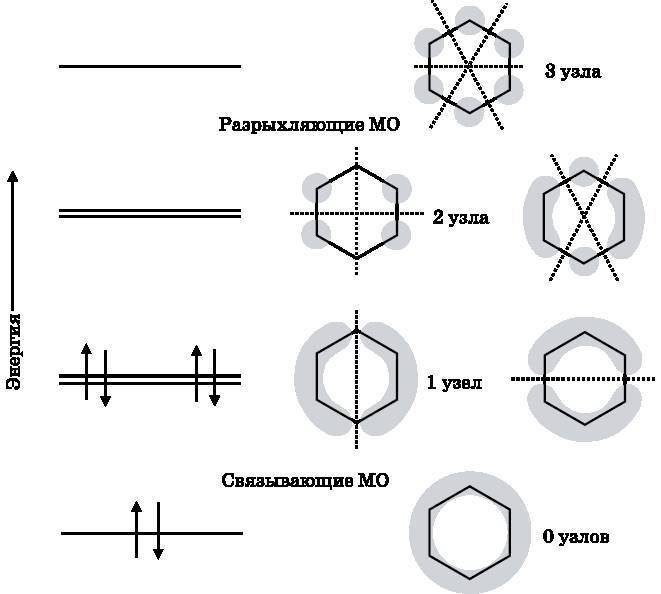
Рис. 18.8. Энергетические уровни бензольных молекулярных ?-орбиталей и схематическое изображение формы соответствующих МО. С увеличением энергии число узлов тоже возрастает. МО с одинаковым числом узлов имеют одинаковую энергию
Сравнивая схемы МО с наименьшей и наибольшей энергией на рис. 18.8, нетрудно увидеть, почему первая МО является связывающей, а вторая — разрыхляющей. У МО с наименьшей энергией электронная плотность распределена между всеми атомами углерода. У разрыхляющей МО с наибольшей энергией между всеми атомами углерода находятся узлы, так что электроны на этой МО не будут связывать атомы углерода друг с другом. Две другие связывающие МО хотя и имеют более высокий энергетический уровень, чем связывающая МО с наименьшей энергией, в итоге всё же соединяют атомы углерода. Каждая из этих МО имеет по одному узлу. Та из них, что изображена слева, помещает электронную плотность между парами атомов углерода, находящимися слева и справа. МО, изображённая справа, помещает электронную плотность между тремя атомами углерода вверху и между тремя атомами углерода внизу. Несмотря на узлы, эти МО объединяются с МО, имеющей наименьшую энергию, и порождают три ?-связи, которые разделяются между всеми шестью атомами углерода. Две вырожденные разрыхляющие МО имеют каждая по два узла. Та из них, что изображена слева, очевидно, не даёт вклада в связывание, поскольку не размещает электронную плотность между какими-либо двумя атомами углерода. МО, изображённая справа, хотя и помещает электронную плотность между двумя парами атомов углерода, но в совокупности с левой орбиталью не даёт связывания.
Поглощение света ароматическими соединениями
Для молекул ароматических соединений квантовая теория позволяет рассчитать молекулярные орбитали, а также их формы и размеры. Есть много способов проверить результаты квантовых вычислений путём сравнения с данными экспериментов. Один из наиболее полезных способов состоит в применении оптической спектроскопии для измерения длин волн (цветов) света, поглощаемого молекулами. Рассмотрим в качестве примера нафталин.
На рис. 18.7 представлена молекулярная диаграмма нафталина, содержащего десять атомов углерода. Каждый атом углерода вносит одну pz-орбиталь с одним электроном в образование делокализованной системы ?-электронов. Ещё три валентных электрона каждого атома углерода служат для образования ?-связей. Десять атомных pz-орбиталей образуют ?-систему, в которой, таким образом, будет десять молекулярных орбиталей: пять связывающих и пять разрыхляющих. В нафталине нет вырожденных МО, каждая имеет свою энергию. На рис. 18.9 схематически изображены энергетические уровни ?-МО нафталина. Слева показаны энергетические ?-уровни с десятью ?-электронами, заполняющими пять связывающих МО. Разрыхляющие МО пустуют.
На рис. 18.9 показан эффект поглощения света. Поскольку энергетические уровни квантуются, молекула может поглощать свет лишь с определёнными значениями энергии. На рисунке ?E — наименьшая энергия света, который может быть поглощён. Рассмотрим, что случится, если направить свет на образец с молекулами нафталина, начиная со света, который имеет слишком низкую энергию, чтобы быть поглощённым молекулами. Энергия света описывается формулой E=h•?, где h — постоянная Планка, а ? — частота. Итак, первоначально ?E>h•?, то есть разница в энергии между верхней занятой молекулярной орбиталью (ВЗМО) и нижней свободной молекулярной орбиталью (НСМО) больше энергии фотонов, проникающих в образец. В результате они пройдут сквозь образец без поглощения. Теперь начнём изменять энергию света, повышая её (от красного к голубому). Когда h•?=?E, свет поглощается, что проявляется в уменьшении количества излучения, проходящего сквозь образец. Электрон возбуждается, переходя с НСМО на ВЗМО. Это возбуждение показано в правой части рис. 18.9, где один электрон находится на ВЗМО и один электрон — на НСМО. В левой части рис. 18.9 на ВЗМО находятся два электрона, а на НСМО — ни одного.
Переход с ВЗМО на НСМО — это энергетически наименее затратный переход. Из рисунка видно, что связывающие МО находятся друг к другу ближе, чем ВЗМО и НСМО. Однако электрон не может возбудиться, перейдя с одной заполненной связывающей МО на другую. Если попытаться забрать электрон с одной связывающей МО и поместить его на другую, то получится МО с тремя электронами. Три электрона на МО нарушают принцип запрета Паули. Поэтому в нашем оптическом эксперименте, в котором цвет излучения меняется от красного к голубому (от низкой энергии к высокой), первым цветом (длиной волны), который подвергается поглощению, будет тот, что соответствует энергии ?E. Значение ?E можно вычислить на основе квантовой механики. Оно зависит от строения молекулы и взаимодействия атомных орбиталей, которые образуют молекулярные орбитали. Результаты квантовых вычислений в дальнейшем можно проверить, сравнивая с длинами волн, при которых будет происходить поглощение, по мере увеличения энергии света, смещающегося по спектру всё ближе к голубому. Второй раз поглощение произойдёт, когда свет сможет поднять электрон с ВЗМО на энергетический уровень, находящийся выше НСМО. Следующее поглощение соответствует переходу электрона с ВЗМО на орбиталь, которая на два энергетических уровня выше НСМО, и т. д.
