Абсолютный минимум. Как квантовая теория объясняет наш мир, стр. 69
«за вклад в понимание электронной структуры и строения молекул, особенно свободных радикалов».
Работа Херцберга по определению строения молекул основывалась во многом на его объяснении колебательных спектров молекул.
Энергия классического мяча для ракетбола меняется непрерывным образом, но энергия квантового мяча (частицы в ящике) привязана к энергетическим уровням (см. рис. 8.6). На рис. 17.3 изображена потенциальная кривая для вибрационной моды молекулы, подобная представленной на рис. 12.1, но теперь на ней также отмечены первые несколько колебательных энергетических уровней. И вновь, как и в случае частицы в ящике, низший энергетический уровень n=0 не соответствует нулевой энергии.
Энергия квантовых колебаний
Простейшая модель для колебательных уровней энергии даёт следующие их значения:
E=h•?•(n+?),
где h — постоянная Планка, ? — частота колебаний, n — квантовое число, которое может принимать значения 0, 1, 2 и т. д. При n=0 энергия равна ?h•?. При n=1 энергия равна 3/2h•?. Таким образом, разность в энергии между низшим энергетическим уровнем и первым возбуждённым колебательным состоянием равна h•?. В этой модели все энергетические уровни отстоят друг от друга на одну и ту же величину h•?. В реальных молекулах c увеличением квантового числа энергетические уровни становятся ближе друг к другу. Для наших целей важна только разность между низшим энергетическим уровнем и первым возбуждённым.
Деформационная мода CO2 поглощает на пике земного черноте?льного спектра
В нижней части рис. 17.3 изображены первые два колебательных энергетических уровня. Свет будет поглощаться при энергии, равной разности между этими уровнями, которая обозначена пунктирной стрелкой. Поскольку эта разность в энергии равна ?E=h•?=c•h/?, измерение частоты (?) и длины волны (?) света, при которой он поглощается, даёт нам частоту осциллятора. Как показано на рисунке, для деформационных мод углекислого газа ?E=667 см?1. Деформационные моды имеют одинаковую частоту, поскольку различаются только направлением изгиба. (Энергию и частоту можно характеризовать числом колебаний волны на единицу длины (см?1), если разделить энергию ?E на c•h.) Частота света, поглощаемого изгибами молекулы CO2, почти в точности совпадает с пиком земного черноте?льного излучения. Растянуть химическую связь намного труднее, чем деформировать (то есть на это требуется больше энергии). Поэтому симметричная и асимметричная моды углекислого газа имеют намного более высокие частоты. Ни одна из них не даёт существенного вклада в поглощение земного черноте?льного излучения.
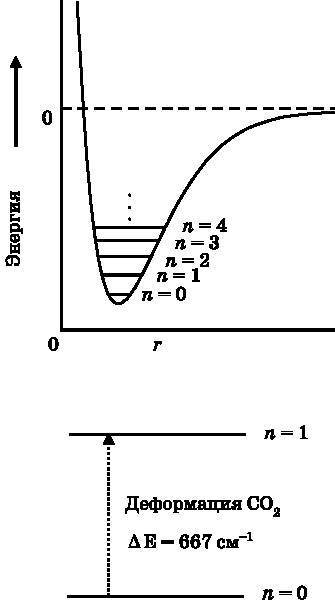
Рис. 17.3. Вверху: кривая потенциальной энергии, показывающая, как энергия зависит от длины химической связи, с отмеченными на ней колебательными квантовыми уровнями. Показаны только несколько первых энергетических уровней. Внизу: низший колебательный энергетический уровень n=0 и первый возбуждённый уровень n=1 для деформационной моды молекулы CO2 (см. рис. 17.2). Данный переход (стрелка) будет поглощать и земное черноте?льное излучение (см. рис. 17.1)
Парниковый эффект CO2 является кванотовомеханическим
Важнейший факт состоит в том, что на са?мом фундаментальном уровне вклад CO2 в парниковый эффект и глобальное изменение климата является принципиально квантовомеханическим. Во-первых, связи, которые разрываются и создаются при горении природного газа, нефти и угля, определяются квантовой механикой, которая порождает молекулярные орбитали и определяет силу химических связей. От силы этих химических связей зависит количество энергии, высвобождаемой в расчёте на одну получающуюся молекулу CO2, а на ещё более фундаментальном уровне форма спектра испускаемого Землёй черноте?льного излучения определяется квантовыми эффектами.
Черноте?льное излучение обсуждалось в главах 4 и 9. Объяснение Планком формы спектра чёрного тела и его изменения с температурой светящегося объекта было первым приложением квантовой теории. Полоса поглощения CO2 располагается вокруг волны с частотой 667 см?1 в результате квантования колебательных уровней молекул — чисто квантового эффекта. Деформационные моды молекулы CO2 характеризуются квантовым переходом между колебательными состояниями n=0 и n=1, энергия которого соответствует ключевой частоте земного черноте?льного спектра. По мере того как мощные электростанции, многочисленные автомобили и самолёты, горящие тропические леса и т. п. выделяют углекислый газ, квантовое взаимодействие между CO2 и земным инфракрасным черноте?льным излучением порождает парниковый эффект.
18. Ароматические молекулы
В главах 13 и 14 говорилось о двойных связях, а в главе 16 мы узнали о том, что двойные связи играют фундаментальную роль в определении биологических свойств жиров. Среди обсуждавшихся молекул были полиненасыщенные жиры, имеющие несколько двойных связей, однако эти двойные связи всегда разделяются некоторым числом одиночных связей. Например, на рис. 16.5 изображена шаростержневая модель молекулы ДГК — полиненасыщенной жирной кислоты с шестью двойными связями. Как легко заметить, между любыми двумя её двойными связями находятся две одиночные связи.
В этой главе мы познакомимся с разнообразными проявлениями множественных двойных связей, которые не разделяются несколькими одиночными связями. Квантовая теория показывает, что связи такого рода, обнаруживаемые в молекуле бензола и многочисленных других «ароматических» молекулах, могут объяснить электропроводность металлов, а также различия между металлами, полупроводниками и диэлектриками, которые будут обсуждаться в главе 19. Для понимания ароматических молекул и электропроводности металлов нам надо начать обсуждение с природы молекулярных орбиталей, которые возникают при взаимодействии одинаковых атомных орбиталей множества атомов.
Бензол: классический ароматический углеводород
На рис 18.1 изображена молекулярная диаграмма бензола, который состоит из шести атомов углерода и шести атомов водорода. Экспериментально было определено, что молекула бензола имеет правильную шестиугольную форму, а все её атомы (и углерод, и водород) лежат в одной плоскости. Угол между связями одного атома углерода с двумя ближайшими соседями составляет ровно 120°, и угол, образованный связью с водородом и с соседним углеродом, тоже равен 120°. Таким образом, три связи, образованные любым из атомов углерода, имеют треугольную геометрию, а значит, они образованы с помощью трёх sp2-гибридизированных атомных орбиталей каждого атома углерода. Итак, у всех атомов углерода остаётся по одной неиспользованной 2p-орбитали, расположенной перпендикулярно плоскости страницы. Обозначим её 2pz. Мы знаем, что углерод всегда образует четыре связи. Здесь углерод связан лишь с тремя другими атомами с помощью трёх связей. 2pz-орбитали должны служить для образования двойных ?-связей, но где они располагаются в молекуле?
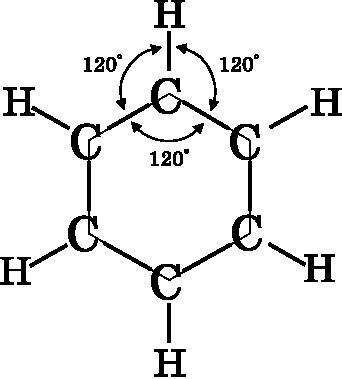
Рис. 18.1. Геометрия молекулы бензола C6H6. Бензол имеет форму правильного плоского шестиугольника
