Абсолютный минимум. Как квантовая теория объясняет наш мир, стр. 39
Например, метан (природный газ) имеет молекулу CH4, в которой каждый атом H связан с центральным атомом C. Углерод совместно использует четыре электрона, по одному от каждого атома водорода, и тем самым получает замкнутую электронную конфигурацию неона. Каждый атом H использует один электрон совместно с атомом C, получая тем самым дополнительный электрон для формирования замкнутой конфигурации электронной оболочки, как у гелия. Это очень важно. За счёт ковалентных связей (совместного использования электронов) каждый атом получает замкнутую конфигурацию оболочки. Другой чрезвычайно важный факт состоит в том, что атом С всегда создаёт четыре связи, поскольку нуждается в совместном использовании четырёх электронов для достижения конфигурации неона. Этот факт играет фундаментальную роль для органической химии и биохимии, что подробно обсуждается в последующих главах.
Следующий элемент — азот. Атом N нуждается в трёх электронах, чтобы достичь конфигурации неона, поэтому он образует три ковалентные связи. Например, он может соединяться с атомами H, образуя молекулу NH3 — аммиак. Кислороду нужно два электрона, чтобы получить замкнутую конфигурацию оболочки неона, так что он образует две связи и, например, участвует в образовании молекулы воды (H2O). Таким образом, из этих простых соображений уже становится понятна последовательность соединений: CH4, NH3 и H2O. Связи, образуемые с участием атомов C, N и O, будут обсуждаться в следующих главах, где идёт речь о молекулах, содержащих эти атомы, но они всегда образуют 4, 3 и 2 связи соответственно.
Следующий элемент — это фтор. Атом фтора лишь на один электрон отстаёт от замкнутой оболочки атома Ne. Он имеет столь сильное сродство к электрону, что склонен образовывать отрицательный ион F1?, захватывая «лишний» электрон. Этот электрон должен откуда-то появиться, и атом F образует соединения, которые в общем случае называются солями. Например, соединение LiF имеет вид белых кристаллов. В этих кристаллах Li, которому нужно отдать электрон, чтобы достичь конфигурации гелия, передаёт электрон атому F. В результате кристалл LiF состоит из ионов Li1+ и ионов F1?. Ионы Li1+ обладают замкнутой оболочкой, как у атома He, а ионы F1? имеют замкнутую оболочку, как у атома Ne.
Кристаллы LiF, как и все соли, легко растворяются в воде. Такой кристалл скрепляется посредством электростатических взаимодействий. Положительные и отрицательные ионы притягиваются друг к другу. Они располагаются в кристалле таким образом, что притяжение между катионами и анионами превосходит отталкивание между одними катионами и другими катионами, а также между одними анионами и другими анионами. Вода может окружать как положительные, так и отрицательные ионы, причём это делает общую энергию системы (воды, окружающей катионы и анионы) ниже, чем у кристалла LiF, погружённого в воду. Это называется сольватацией. Вода сольватирует ионы, и поэтому ионные кристаллы, такие как LiF, растворяются в воде. Сольватация обсуждается в главе 15.
Атом F будет образовывать соли с атомами из левой части таблицы, которым нужно отдавать электроны, чтобы достичь замкнутой конфигурации оболочки. В молекуле LiF фтор получает электрон, а литий его отдаёт. F также может получить заполненную оболочку, такую как у неона, создав другого рода ковалентные связи. Как описывается ниже, он может соединиться с серой (S), образовав SF2.
За фтором в Периодической таблице следует неон. Он имеет заполненную оболочку (см. рис. 11.5). Атом Ne не стремится ни присоединять, ни отдавать электроны. Он не образует химических соединений. Ne завершает вторую строку Периодической таблицы.
За неоном идёт натрий. У него на один (3s) электрон больше, чем в конфигурации Ne. Как и Li, находящийся прямо над ним, Na будет легко отдавать электроны, образуя катион Na1+. Сделав это, он получает такую же электронную конфигурацию, как у Ne. Твёрдый натрий является металлом, который проводит электричество (электроны), поскольку его 3s-электрон слабо с ним связан. Подобно LiF, соединение NaF — это соль, которая хорошо растворима в воде.
Следующим идёт магний. Mg будет отдавать два электрона для достижения неоновой замкнутой конфигурации оболочки, образуя ионы Mg2+. Это металл, который проводит электричество, поскольку он легко отдаёт два своих 3s-электрона. Он будет образовывать соли, например MgF2. Это означает, что в кристалле содержится два аниона фтора на каждый катион магния с зарядом +2. MgF2 хорошо растворяется в воде.
За магнием следует алюминий. Твёрдый алюминий является металлом. Алюминий образует катионы Al3+.
Как и в случае с углеродом во второй строке, на кремнии всё меняется. Si будет создавать четыре ковалентные связи, чтобы совместно использовать (фактически присоединять) четыре электрона, получив тем самым замкнутую конфигурацию электронной оболочки аргона (см. Периодическую таблицу). Например, кремний образует соединение SiH4. Фосфор для достижения такой конфигурации, как у аргона, будет создавать три ковалентные связи, например PH3, а сере потребуются две ковалентные связи для получения заполненной оболочки аргона. Она образует сероводород H2S — ядовитый газ, обладающий очень резким запахом тухлых яиц. Как уже отмечалось, сера может также создавать ковалентные связи, образуя соединение SF2.
За серой следует хлор. Подобно фтору, который нуждается лишь в одном электроне, чтобы сформировать замкнутую конфигурацию оболочки неона, атому Cl требуется лишь один электрон, чтобы получить замкнутую конфигурацию электронной оболочки аргона, так что он склонен образовывать ион Cl1?, присоединяя лишний электрон. В Периодической таблице элементы в столбце рядом с благородными газами, то есть во второй колонке справа, образуют анионы с зарядом ?1. Эти элементы (F, Cl, Br, I, At) называются галогенами. Хлор даёт нам обычную поваренную соль — хлорид натрия NaCl — кристаллы, состоящие из ионов Na1+ и Cl1?. Как и LiF, NaCl может растворяться в воде, поскольку катионы и анионы сольватируются молекулами H2O. Это существенно отличается от поведения метана CH4, который не растворяется в воде. Углерод и атомы водорода достигают замкнутости своих оболочек за счёт совместного использования электронов посредством образования ковалентных связей. Если молекулу метана разделить на части, оболочки атомов перестанут быть замкнутыми. В этом отличие от кристалла NaCl, который может распадаться на Na1+ и Cl1?, причём катион и анион имеют заполненные оболочки. Молекулы, содержащие только углерод и водород, из которых состоят нефть, бензин и метан, называются углеводородами. Они нерастворимы в воде. Углеводороды обсуждаются в главах 14, 15 и 16.
За Cl следует аргон (Ar), который имеет замкнутую электронную оболочку (рис. 11.6). У него 18 электронов, два из них — 1s, два — 2s, шесть находится на трёх 2p-орбиталях, два — на 3s-орбиталях и шесть — на трёх 3p-орбиталях. Аргон — инертный газ. Он не образует химических соединений {18}.
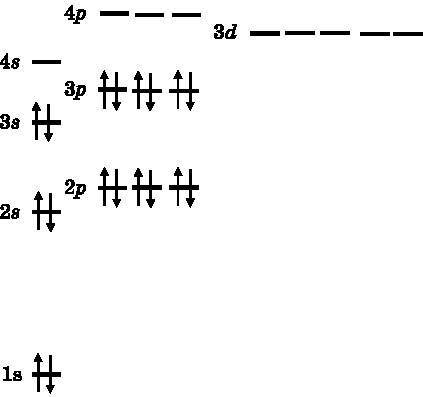
Рис. 11.6. Электронная конфигурация аргона (Ar, 18). Третья оболочка заполнена
При движении сверху вниз по столбцам атомы становятся крупнее
Чем ниже мы спускаемся по столбцам Периодической таблицы, тем больше становятся размеры атомов. Так, атом Li крупнее атома H, атом Na больше атома Li и т. д. Это объясняется двумя обстоятельствами. Во-первых, дополнительные электроны занимают орбитали с бо?льшим главным квантовым числом n. Атом H имеет 1s-электрон, атом Li — 2s-электрон, атом Na — 3s-электрон. Глядя на рис. 10.2-10.6, которые относятся к атому водорода, можно заметить, что волновая функция 3s намного больше, чем 2s, которая, в свою очередь, намного больше, чем 1s. Однако по мере движения вниз по столбцам возрастает также и положительный заряд ядра. Заряд ядра — это то же самое, что и атомный номер, который есть у всех атомов в Периодической таблице и приведён в списке элементов. С увеличением положительного заряда ядра отрицательно заряженные электроны притягиваются всё ближе к нему. Однако этого недостаточно, чтобы скомпенсировать тот факт, что по мере спуска по столбцам таблицы электроны занимают орбитали со всё большим главным квантовым числом (n). Увеличение размеров с ростом n оказывается значимее эффекта усиливающегося притяжения электронов к ядру, так что размеры атомов при спуске вниз по столбцам возрастают.
