Абсолютный минимум. Как квантовая теория объясняет наш мир, стр. 31
Если Ридберг получил экспериментальные данные и вывел эмпирическую формулу, описывающую линии спектра атома водорода, то в решении Шрёдингера для задачи об атоме водорода квантовая теория используется совершенно иным образом. Мы немного задержимся, чтобы восхититься триумфом квантовой теории, достигнутым в 1925 году. При выводе Шрёдингером энергетических уровней атома водорода не использовалось никаких подгоночных параметров. Все необходимые константы — это фундаментальные свойства частиц и электростатического взаимодействия, благодаря которому отрицательно заряженный электрон притягивается к положительно заряженному протону. Шрёдингер не обращался к экспериментальным данным, чтобы подогнать константу RH для лучшего совпадение с ними. Он создал теоретический формализм и применил его к атому водорода. Его теория в точности воспроизвела результаты экспериментальных наблюдений — спектральные линии атома водорода, опираясь только на фундаментальные постоянные.
В отличие от теории Бора уравнение Шрёдингера с успехом применялось к огромному числу других задач, включая атомы, отличные от водорода, а также небольшие и крупные молекулы. Как уже упоминалось, для систем крупнее атома водорода, то есть для атомов и молекул, состоящих более чем из двух частиц, уравнение Шрёдингера нельзя решить точно. Однако было разработано множество эффективных приближённых методов решения уравнения Шрёдингера для атомов, молекул и других типов квантовомеханических систем. Благодаря развитию компьютеров и их огромной вычислительной мощности стало возможно решать уравнение Шрёдингера для очень больших и сложных молекул. В следующих главах рассказывается о формах молекул. Решение уравнения Шрёдингера для молекулы даёт её энергетические уровни и волновые функции. Волновые функции содержат информацию, необходимую для определения формы молекул.
Четыре квантовых числа
Энергии различных состояний атома водорода описываются единственным квантовым числом n. Однако в действительности есть четыре квантовых числа, связанных с электронами в атомах. Они появляются при решении задачи об атоме водорода в рамках квантовой теории. Одно из них существенно лишь для атомов и молекул, имеющих более одного электрона. В этом смысле атом водорода является частным случаем, поскольку в нём всего один электрон. Для атома водорода, помимо главного квантового числа n, есть ещё два квантовых числа — l и m. Число l называется орбитальным квантовым числом, m — магнитным квантовым числом. От них в сочетании с квантовым числом n зависит, сколько различных состояний связано с конкретным значением энергии, они также определяют форму волновых функций. Четвёртое квантовое число обозначается s. Его называют спи?новым квантовым числом.
Когда Бор решал задачу об атоме водорода, в рамках старой квантовой теории считалось, что электрон движется по орбитам, имеющим разные формы и значения энергии. Корректное квантовое решение Шрёдингера для атома водорода даёт энергетические уровни и волновые функции, которые соответствуют боровским орбитам и называются «орбиталями». Обсуждая атомы и молекулы, мы часто используем термины «волновая функция» и «орбиталь» в качестве синонимов. Орбитали являются волнами амплитуды вероятности, которые подчиняются принципу неопределённости Гейзенберга, чем отличаются от боровских орбит.
Как уже отмечалось выше, главное квантовое число n может принимать целочисленные значения n?1, то есть 1, 2, 3, 4 и так далее, а l может принимать значения от 0 до n?1 с целым шагом. Число m может иметь значения от l до ?l с целым шагом. Наконец, число s может принимать только два значения: +? и ??. Сводка возможных значений квантовых чисел приведена в таблице ниже.
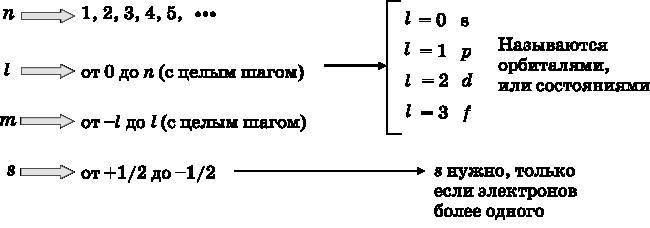
По историческим причинам состояния с различными значениями квантового числа l имеют индивидуальные обозначения. Состояние l=0 называется s-орбиталью. При l=1 говорят о p-орбитали, при l=2 — это d-орбиталь, а при l=3 — f-орбиталь. Для обсуждения всех атомов нам не понадобится заходить далее f-орбиталей, то есть l=3. Как показано ниже, различные орбитали имеют разные формы.
Поскольку энергии состояний (орбиталей) атома водорода зависят только от квантового числа n, для n>1 имеется более одного состояния с одинаковой энергией. Для n=1 имеем l=0 и m=0 (см. таблицу), поэтому существует единственная орбиталь с n=1. Для этой орбитали l=0, так что её обозначают как 1s-орбиталь. Для n=2 число l может быть равно 0, что даёт 2s-орбиталь. Однако для n=2 число l также может равняться 1. При l=1 число m может быть равно 1, 0 или ?1 (см. таблицу). При l=1 — это p-орбиталь, причём существуют три разные p-орбитали, обозначаемые 2p1, 2p0 и 2p?1. Здесь 2 — это главное квантовое число n, p означает l=1, а три индекса— это три возможных значения m. Таким образом, для n=2 существует четыре различных состояния.
Если n=3, то l может быть равно нулю, что даёт 3s-орбиталь. Также l может быть равно 1, что при m = 1, 0 и ?1 даёт орбитали 3p1, 3p0, и 3p?1. Кроме того, l может быть равно 2. Для l=2 число m может иметь значения 2, 1, 0, ?1 и ?2. Это d-орбитали: 3d2, 3d1, 3d0, 3d?1 и 3d?2. Всего имеется пять d-орбиталей. Таким образом, для n=3 имеется девять различных состояний: одна s-орбиталь, три p-орбитали и пять d-орбиталей. Когда n=4, есть 4s-орбиталь, три различные 4p-орбитали (4p1, 4p0 и 4p?1), пять различных 4d-орбиталей (4d2, 4d1, 4d0, 4d?1 и 4d?2). Дополнительно имеется семь f-орбиталей: 4f3, 4f2, 4f1, 4f0, 4f?1, 4f?2 и 4f?3. Таким образом, для n=4 имеется в общей сложности 16 состояний: одна s-орбиталь, три p-орбитали, пять d-орбиталей и семь f-орбиталей.
Как уже говорилось, каждая из этих орбиталей имеет свою форму. Довольно часто орбитали называют в соответствии с их формой. Например, три различных 2p-орбитали, вместо того чтобы обозначать их 2p1, 2p0 и 2p?1, называют 2px, 2pz и 2py. Связь между этими индексами и формами прояснится, когда мы познакомимся с соответствующими формами.
Энергетические уровни атома водорода
На рис. 10.1 представлена диаграмма энергетических уровней атома водорода. Изображены уровни с n от 1 до 5. Для удобства восприятия масштаб интервалов не соблюдается, но, как и показано, с увеличением n интервал между уровнями становится меньше. Также с увеличением n возрастает число различных состояний (орбиталей), соответствующих конкретному значению n. Водород — это особый случай, поскольку у него имеется лишь один электрон. Для водорода все орбитали с одинаковым значением n обладают равной энергией. В следующей главе будет объяснено, что в атомах с несколькими электронами орбитали с разными значениями l при одном и том же n обладают разными энергиями.
