Абсолютный минимум. Как квантовая теория объясняет наш мир, стр. 27
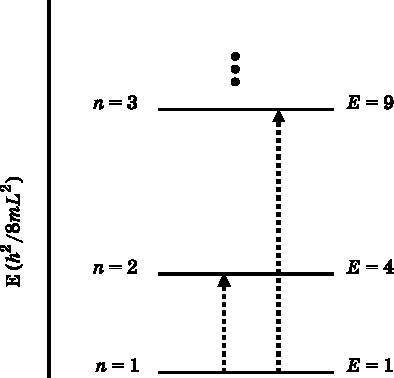
Рис. 8.7. Энергетические уровни частицы в ящике. n — квантовое число, энергия E выражена в единицах h2/8•m•L2. Стрелками обозначено поглощение фотонов, которое может привести к переходу электрона с низшего энергетического уровня n=1 на более высокие энергетические уровни n=2, n=3 и т. д. Чтобы фотон был поглощён, его энергия должна совпадать с разностью энергий квантовых уровней
Цвет фруктов
Подставим в формулы численные значения постоянной Планка h=6,6•10?34 Дж•cек и массы электрона me=9,1•10?31 кг. В качестве длины ящика L примем средний размер молекулы: L=0,8•10?9 м (0,8 нанометра, 0,8 нм). Тогда
?E= 3•(6,6•10?34)2 / 8•(9,1•10?31)•(0,8•10?9)2= 2,8•10?19 Дж.
Разделив полученное значение энергии на h, получим частоту ?=4,25•1014 Гц, которая соответствует длине волны поглощаемого света ?=7,06•10?7 = 706 нм. Свет с длиной 706 нм находится у самого красного края видимого спектра. Что случится, если размер ящика (молекулы) будет меньше и составит, допустим, 0,7 нм, а не 0,8 нм? Энергия поглощаемого света при этом будет больше, а значит, с уменьшением размеров ящика длина волны поглощаемого света становится меньше. Поглощаемая энергия обратно пропорциональна L2 (L2 находится в знаменателе). Это означает, что с уменьшением размера ящика интервал между энергетическими уровнями увеличивается, а разность энергий возрастает как квадрат длины ящика. Таким образом, для ящика длиной 0,7 нм поглощаемая длина волны составит ?=540 нм, что соответствует зелёному свету. Если же размер ящика будет ещё меньше, допустим 0,6 нм, то ?=397 нм, и это самый голубой край спектра света, видимого невооружённым глазом.
Эти результаты в общих чертах справедливы и для молекул, хотя при этом необходимо принимать в расчёт множество тонкостей. Однако для ряда молекул, имеющих в целом сходную структуру (типы атомов и т. п.), чем крупнее молекула, тем более красный свет она поглощает. Наши результаты, полученные для частицы в ящике, демонстрируют на сугубо качественном уровне, почему вещи бывают разного цвета. Маленькие молекулы поглощают свет в ультрафиолетовой части спектра. Мы не видим ультрафиолет, так что поглощение малыми молекулами не влияет на цвет. Мы видим те цвета, которые содержатся в свете, отражённом от объекта. Цвета, которые соответствуют поглощаемым длинам волн, не отражаются. Крупные молекулы поглощают в видимой части спектра, и именно молекулярное поглощение придаёт вещам их цвет.
Вишня имеет красный цвет, а черника — синий, потому что в них содержатся различные молекулы, которые сильно поглощают волны разной длины, соответствующие разным цветам света. В этих молекулах есть квантованные электронные переходы. За счёт переходов из своих основных электронных состояний в возбуждённые состояния они могут поглощать световые волны только таких длин, которые определяются их квантованными энергетическими уровнями. В случае частицы в ящике значения энергии переходов для электрона определяются исключительно длиной ящика и массой электрона. Для молекул квантование энергии переходов, а значит длины волн и цвета, определяется как размерами молекул, так и особенностями их строения, то есть формой молекул, типами атомов, из которых они состоят, и тем, как атомы расположены.
Красители — это молекулы, обладающие свойством поглощать строго определённые волны видимого диапазона спектра. Красители используются для придания различного цвета нашей одежде. Ярко окрашенные растения, зелёные листья и красные розы содержат большой набор молекул разных размеров и форм, которые поглощают свет в определённых участках спектра. Именно размеры и формы этих молекул придают растениям их замечательные цвета. Если молекулы интенсивно поглощают зелёный и красный цвета, отражаться от объекта будет голубой цвет, и он будет выглядеть голубым. Если выраженно поглощаются голубой и зелёный, то отражаться будет преимущественно красный свет и объект будет выглядеть красным. То, какие цвета будут поглощаться объектом, определяется квантованием энергетических уровней в его молекулах.
В повседневной жизни мы постоянно видим различные цвета. Цвет — одно из множества свойств предметов, объясняемых только на основе квантовой механики. Однако есть много других подобных свойств. Например, когда вы включаете электрообогреватель, его спираль нагревается. Почему при прохождении электрического тока по металлу вырабатывается тепло (см. главу 19)? Это ещё одно повседневное квантовое явление. Почему углекислый газ является парниковым (см. главу 17)? Что такое транс-жиры (см. главу 16)? Для того чтобы понять свойства таких систем, необходимо погрузиться в квантовую механику молекулярных структур. В следующих главах мы рассмотрим квантовое описание атомов и молекул и применим его к ряду широко известных ситуаций и задач. Необходимый аппарат для понимания свойств атомов и молекул разрабатывается в главах с 9-й по 14-ю. Эти главы содержат огромное количество интересной информации о поведении атомов и молекул, которая позволяет перекинуть мост от общих идей квантовой теории, с которыми мы до сих пор знакомились, к пониманию множества окружающих нас явлений.
9. Атом водорода: история
В главе 8 мы обсудили задачу о частице в ящике. Мы представили себе электрон, запертый в очень маленьком одномерном ящике, изображённом на рис. 8.1. Задача о частице в ящике полезна тем, что используемый в ней математический аппарат достаточно прост, чтобы, приложив небольшие усилия, найти квантованные энергетические уровни. Нами была получена формула, которая показывает, что энергетические состояния частицы в ящике представляют собой дискретные ступени, зависящие от квантового числа n, которое принимает целые значения, начиная с единицы. Отмечалось, однако, что это крайне искусственный пример удержания квантовой частицы. В природе не бывает по-настоящему одномерных систем. Кроме того, стенки ящика бесконечно высоки и совершенно непроницаемы. Это тоже физически неосуществимо. Как говорилось при обсуждении фотоэлектрического эффекта в главе 4, если энергии фотона хватает на преодоление энергии связи электронов с атомами в куске металла, то взаимодействие такого фотона с первоначально связанным электроном может выбить его из металла (см. рис. 4.3).
Тем не менее по ряду причин изучать частицу в ящике очень полезно. Во-первых, обнаруживается, что энергетические уровни квантуются (см. рис. 8.6). В противоположность классической механике, энергия, которой может обладать электрон, запертый в ящике размером с атом или молекулу, не является непрерывной величиной. Она может меняться только дискретными шагами. Фотон с подходящей энергией может возбудить электрон, переведя его с одного энергетического уровня на другой (см. рис. 8.7). Энергия такого фотона должна совпадать с разностью между энергией того уровня, на который он переходит, и энергией того уровня, который он покидает. Однако в отличие от реальных систем никакая энергия не способна выбить электрон из ящика, поскольку его стенки бесконечно высоки. Это способ сказать, что электрон имел бы бесконечно большую энергию за пределами ящика. Ящик представляет собой бесконечно глубокий колодец, и электрон сидит в нём как в ловушке; никакая конечная энергия не способна преодолеть бесконечную энергию связи.
