По ту сторону кванта, стр. 19
Таким образом, в магнитном поле каждый уровень Enl с заданными значениями квантовых чисел n и l расщепится ещё на (2l + 1) подуровня, Enlm, каждый из которых однозначно определяется заданием трёх целых квантовых чисел: n, l, m. А это, мы знаем, приводит к дополнительному расщеплению спектральных линий.
Усложняясь, теория Бора постепенно теряла своё первоначальное изящество и наглядность. На её место пришла формальная модель атома, от которой требовалось лишь одно: дать правильную систематику термов. Термин «квантование» постепенно потерял свой прежний смысл: им обозначали теперь формальный процесс сопоставления целых (квантовых) чисел n, l и m каждому уровню энергии в атоме, а точнее, тому типу движения, в котором находится электрон. Квантовые числа n, l и m определяют стационарные орбиты в изолированном атоме. Внешние поля (электрическое и магнитное) влияют на движение электрона в атоме (расщепление уровней энергии), а это сразу же сказывается на структуре светового сигнала, который испускает атом (расщепление спектральных линий).
ФОРМАЛЬНАЯ МОДЕЛЬ АТОМА
Популяризация (как и всякая наука) имеет свои границы. Как правило, они определяются тем, что с некоторого момента становится невозможным использовать понятия и образы повседневной жизни. Для того чтобы эту границу преодолеть, нужно перейти на язык формальных понятий науки (для начала хотя бы примитивный). При всех попытках уйти от этого шага неизбежно возникает неосознанное глухое недовольство, а самая суть науки остаётся скрытой. Наоборот, преодолев минимальные затруднения, вы можете почувствовать силу логических построений науки и оценить красоту их следствий. Как правило, возникающие технические затруднения ничуть не больше тех, с которыми сталкивается любой школьник при изучении химии: довольно быстро он убеждается, что проще (а главное — понятнее) написать формулу H2O, чем каждый раз говорить: «Молекула, которая состоит из двух атомов водорода и одного атома кислорода».

Нечто похожее на химические формулы принято и в теории спектров, где главное квантовое число n обозначают цифрами: 1, 2, 3…, а орбитальный момент l — буквами, причём ряду чисел 0, 1, 2, 3,… соответствует ряд букв s, p, d, f, …
Поэтому символ 3s, например, соответствует уровню энергии с квантовыми числами n = 3, l = 0, а символ 3p — уровню с n = 3, l = 1.
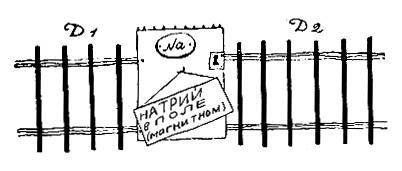
В невозбуждённом атоме натрия излучающий электрон находится в состоянии 3s. А тёмная линия D возникает в том случае, если при возбуждении атома электрон переходит в состояние 3p. При обратном переходе 3p>3s он излучает энергию и возникает ярко-жёлтая линия D.
А что произойдёт, если излучающий натрий поместить в магнитное поле? Вначале, следуя Зоммерфельду, предполагали, что при этом верхний уровень 3p должен расщепиться на 3 компоненты 2l + 1 = 2•1 + 1 = 3, а нижний останется без изменения. В итоге каждая из линий D1 и D2 должна расщепиться на 3 компоненты.
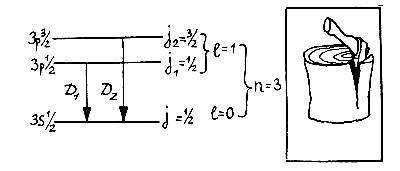
Опыт противоречит такому заключению. Из рисунка видно, что линия D1 расщепляется на 4 компоненты, а линия D2 — на 6. Это явление — частный случай так называемого аномального эффекта Зеемана. Чтобы понять его причину, необходимо немного возвратиться назад и уяснить себе вопрос, которого мы раньше сознательно избегали: почему даже в отсутствие магнитного поля D-линия натрия состоит из двух тесно расположенных компонент D1 и D2?
Мучительно размышляя над этим вопросом, ученик Зоммерфельда Вольфганг Паули (1900–1958) пришёл в 1924 году к открытию спи?на электрона (от английского слова spin — веретено). Он рассуждал примерно так: обе линии D1 и D2 соответствуют одному и тому же переходу с уровня n = 3, l = 1 на уровень n = 3, l = 0. Но их всё-таки две! Значит, существует не один, а два верхних уровня 3p и ещё какое-то дополнительное квантовое число, которое их различает: Свойство, которому соответствует это четвёртое квантовое число S, он назвал «неклассической двузначностью электрона» и предположил, что оно может принимать только два значения: +? и ??. Паули считал, что наглядное представление этого свойства невозможно.
Но уже в следующем году Джордж Уленбек (род. 1900) и Сэмюэл Гаудсмит (род. 1902) нашли наглядную модель для объяснения этого свойства электрона, допустив, что он вращается вокруг своей оси. Такая модель прямо следовала из аналогии между атомом и солнечной системой: ведь Земля вращается не только по эллипсу вокруг Солнца, но ещё и вокруг своей оси (эту аналогию отмечал и Комптон в 1921, а Крониг — в 1923 году, но Паули резко против неё восстал).
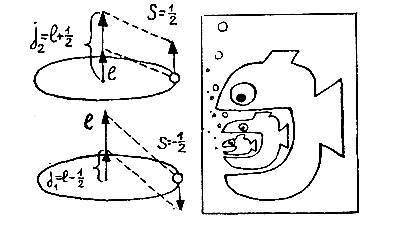
Уленбек и Гаудсмит предположили, что, кроме орбитального момента l, значения которого — целые числа и который возникает при движении по эллипсу, электрону присущ внутренний момент вращения, или спин S, равный по величине S = ?. Складываясь с орбитальным моментом l, этот внутренний момент S может его увеличить или уменьшить. В результате возникает полный момент j, равный либо j1= l ? ?, либо j2= l + ?, в зависимости от взаимной ориентации векторов l и S. Если же l = 0, то полный момент и спин совпадают (j = S = ?).
Теперь всё встало на свои места: уровень 3s в атоме натрия останется без изменения, так как соответствует моменту l = 0, но уровень 3p расщепится на два: 3p? и 3p3/2, энергии которых немного различны.
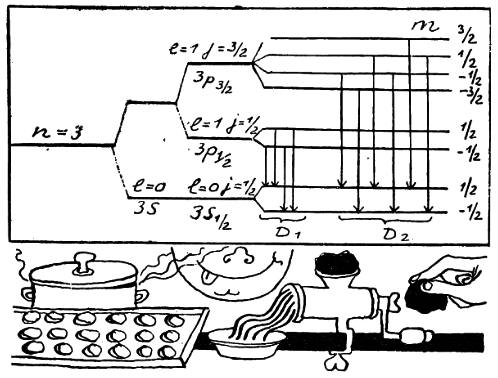
В магнитном поле каждый из уровней с полным моментом j (как и в случае момента l) расщепляется ещё на (2j + 1) компонент, которые различаются значением магнитного квантового числа m. Таким образом, каждый из уровней 3s? и 3p? расщепится ещё на два подуровня, а уровень 3p3/2 — на четыре. В результате возникает та схема уровней и переходов между ними, которая изображена на рисунке (стр. 94) и которая полностью объясняет структуру линий.
Из рисунка видно, как усложнялась первоначальная модель Бора, в которой существовал только один уровень с n = 3. Когда приняли во внимание теорию относительности, он расщепился на два — 3p (n = 3, l = 1) и 3s (n = 3, l = 0). С учётом спина электрона уровень 3p расщепляется ещё на два подуровня — 3p? (n = 3, l = 1, j = ?) и 3p3/2 (n = 3, l = 1, j = 3/2). И наконец, в магнитном поле мы получим систему уровней, изображённую на нашем рисунке, которая приводит к картине спектральных линий, наблюдаемых на опыте.
Модель Бора
Гипотеза о спине электрона — одна из самых глубоких в физике. Вполне осмыслить её значение, не удалось до сих пор. И Паули был, конечно, прав, предостерегая от прямолинейных попыток представлять электрон как вращающийся волчок.
