Физика для всех. Молекулы, стр. 23
Если поместить в закрытый сосуд при нуле градусов воду с плавающим льдом, то в свободное пространство начнут поступать водяные (и "ледяные") пары. При давлении паров 4,6 мм рт. ст. испарение прекратится, и начнется насыщение. Теперь три фазы - лед, вода и пар - будут в состоянии равновесия. Это и есть тройная точка.
Соотношения между различными состояниями наглядно и отчетливо показывает диаграмма для воды, изображенная на рис. 4.11.
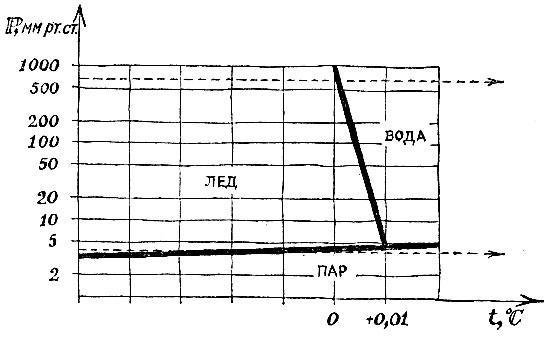
Рис. 4.11
Такую диаграмму можно построить для любого тела.
Кривые на рисунке нам знакомы - это кривые равновесия между льдом и паром, льдом и водой, водой и паром. По вертикали, как обычно, откладывается давление, по горизонтали - температура.
Три кривые пересекаются в тройной точке и делят диаграмму на три области - жизненные пространства льда, воды и водяного пара.
Диаграмма состояния - это сжатый справочник. Ее цель - дать ответ на вопрос, какое состояние тела устойчиво при таком-то давлении и такой-то температуре.
Если в условия "левой области" поместить воду или пар, то они станут льдом. Если в "нижнюю область" внести жидкость или твердое тело, то получится пар. В "правой области" пар будет конденсироваться, а лед плавиться.
Диаграмма существования фаз позволяет сразу же ответить, что произойдет с веществом при нагревании или при сжатии. Нагревание при неизменном давлении изобразится на диаграмме горизонтальной линией. Вдоль этой линии слева направо движется точка, изображающая состояние тела.
На рисунке изображены две такие линии, одна из них - это нагревание при нормальном давлении. Линия лежит выше тройной точки. Поэтому она пересечет сначала кривую плавления, а затем, за пределами чертежа, и кривую испарения. Лед при нормальном давлении расплавится при температуре 0°С, а образовавшаяся вода закипит при 100°С.
Иначе будет обстоять дело для льда, нагреваемого при очень небольшом давлении, скажем, чуть ниже 5 мм рт. ст. Процесс нагревания изобразится линией, идущей ниже тройной точки. Кривые плавления и кипения не пересекаются этой линией. При таком незначительном давлении нагревание приведет к непосредственному переходу льда в пар.
На рис. 4.12 эта же диаграмма показывает, какое интересное явление произойдет при сжатии водяного пара в состоянии, помеченном на рисунке крестиком. Сначала пар превратится в лед, а затем расплавится. Рисунок позволяет тут же сказать, при каком давлении начнется рост кристалла и когда произойдет плавление.
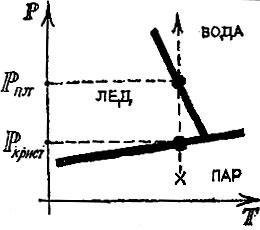
Рис. 4.12
Диаграммы состояния всех веществ похожи одна на другую. Большие, с житейской точки зрения, различия возникают из-за того, что место нахождения тройной точки на диаграмме может быть у разных веществ самым различным.
Ведь мы существуем вблизи "нормальных условий", т. е. прежде всего при давлении, близком к одной атмосфере. Как расположена тройная точка вещества по отношению к линии нормального давления - для нас очень существенно.
Если давление в тройной точке меньше атмосферного, то для нас, живущих в "нормальных" условиях, вещество относится к плавящимся. При повышении температуры оно сначала превращается в жидкость, а потом закипает.
В обратном случае - когда давление в тройной точке выше атмосферного - мы при нагревании не увидим жидкости, твердое вещество будет прямо превращаться в пар. Так ведет себя "сухой лед", что очень удобно для продавцов мороженого. Брикеты мороженого можно перекладывать кусками "сухого льда" и не бояться при этом, что мороженое станет мокрым. "Сухой лед" - это твердый углекислый газ С02. Тройная точка этого вещества лежит при 73 атм. Поэтому при нагревании твердого СО2 точка, изображающая его состояние, движется по горизонтали, пересекающей только лишь кривую испарения твердого тела (так же, как и для обычного льда при давлении около 5 мм рт. ст.).
Мы уже рассказали читателю, каким образом определяется один градус температуры по шкале Кельвина, или, как требует сейчас говорить система СИ,- один кельвин. Однако речь шла о принципе определения температуры. Не все институты метрологии обладают идеальными газовыми термометрами. Поэтому шкалу температуры строят с помощью фиксированных природой точек равновесия между разными состояниями вещества.
Особую роль при этом играет тройная точка воды. Градус Кельвина определяют сейчас как 273,16-ю часть термодинамической температуры тройной точки воды. Тройная точка кислорода принята равной 54,361 К. Температура затвердевания золота положена равной 1337,58 К. Пользуясь этими реперными точками, можно точно отградуировать любой термометр.
Одни и те же атомы, но... разные кристаллы
Черный матовый мягкий графит, которым мы пишем, и блестящий прозрачный, твердый, режущий стекло алмаз построены из одних и тех же атомов углерода. Почему же так различны свойства этих двух одинаковых по составу веществ?
Вспомните решетку слоистого графита, каждый атом которого имеет трех ближайших соседей, и решетку алмаза, атом которого имеет четырех ближайших соседей. На этом примере отчетливо видно, что свойства кристаллов определяются взаимным расположением атомов. Из графита делают огнеупорные тигли, выдерживающие температуру до двух-трех тысяч градусов, а алмаз горит при температуре выше 700°С; плотность алмаза 3,5, а графита - 2,3; графит проводит электрический ток, алмаз - не проводит, и т. д.
Этой особенностью давать разные кристаллы обладает не только углерод. Почти каждый химический элемент, и не только элемент, но и любое химическое вещество, может существовать в нескольких разновидностях. Известно шесть разновидностей льда, девять разновидностей серы, четыре разновидности железа.
Обсуждая диаграмму состояния, мы не говорили о разных типах кристаллов и нарисовали единую область твердого тела. А эта область для очень многих веществ делится на участки, каждый из которых соответствует определенному "сорту" твердого тела или, как говорят, определенной твердой фазе (определенной кристаллической модификации).
аждая кристаллическая фаза имеет свою область устойчивого состояния, ограниченную определенным интервалом давлений и температур. Законы превращения одной кристаллической разновидности в другую - такие же, как законы плавления и испарения.
Для каждого давления можно указать температуру, при которой оба типа кристаллов будут мирно сосуществовать. Если повысить температуру, кристалл одного вида будет превращаться в кристалл второго вида. Если понизить температуру, то произойдет обратное превращение.
Чтобы при нормальном давлении красная сера превратилась в желтую, нужна температура ниже 110°С. Выше этой температуры, вплоть до точки плавления, устойчив порядок расположения атомов, свойственный красной сере. Температура падает,- колебания атомов уменьшаются, и, начиная со 110°С, природа находит более удобный порядок расположения атомов. Происходит превращение одного кристалла в другой.
Шести разным льдам никто не придумывал названия. Так и говорят: лед один, лед два, ...., лед семь. Как же ceмь, если всего шесть разновидностей? Дело в том, что лед четыре при повторных опытах не обнаружен.
Если сжимать воду при температуре около нуля, то при давлении около 2000 атм образуется лед пять, а при давлении около 6000 атм - лед шесть.
Лед два и лед три устойчивы при температурах ниже нуля градусов.
Лед семь - горячий лед; он возникает при сжатии горячей воды до давлений около 20 000 атм.
Все льды, кроме обычного, тяжелее воды. Лед, получающийся при нормальных условиях, ведет себя, аномально; наоборот, лед, полученный при условиях, отличных от нормы, ведет себя нормально.
Мы говорим, что каждой кристаллической модификации свойственна определенная область существования. Но если так, то каким же образом существуют при одинаковых условиях графит и алмаз?
