Химия. Полный справочник для подготовки к ЕГЭ, стр. 56
1) 22,4
2) 40,32
3) 13,44
4) 26,88
5. Для полного сгорания 17,92 л (н.у.) смеси СН 4+ Н 2потребовался 1 моль кислорода. В исходной смеси объемное отношение СН 4: Н 2равно:
1) 2: 1
2) 1: 1
3) 1: 2
4) 3: 2
6. Газ А,полученный при прокаливании 0,04 моль КClO 3на катализаторе, смешали (при н. у.) в сосуде с газом Б,выделившимся при обработке 6 г кальция водой, и получили смесь с объемным отношением А: Б,равным
1) 1: 5
2) 2: 5
3) 3: 4
4) 5: 7
7. После сжигания нитробензола в избытке кислорода получена смесь продуктов (азот, углекислый газ, вода), в которой содержится 4 л (н. у.) азота, а объемное отношение N 2: O 2равно 4: 1. В этих условиях исходный объем (в литрах, н. у.) кислорода составлял
1) 11,2
2) 22,4
3) 25,5
4) 51,0
8. Проведено термическое разложение 1 моль хлорида аммония в стальном баллоне, уже содержавшем 11,2 л (н. у.) аммиака. Конечное объемное отношение NH 3: НCl равно
1) 5: 2
2) 3: 2
3) 5: 1
4) 3: 1
9. Смесь кислорода и хлора с объемным отношением 9: 1 использована для выделения 0,5 моль простого вещества из раствора KI, следовательно, общий объем (в литрах, н. у.) затраченной смеси газов равен
1) 5,6
2) 56
3) 11,2
4) 112
10. Через озонатор пропустили кислород, полученный при прокаливании 1 моль КClO 3на катализаторе, при этом 5 % кислорода превратилось в озон и на выходе из озонатора объемное отношение O 2: O 3составило
1) 23: 1
2) 23: 2
3) 29: 1
4) 29: 2
15.3. Масса вещества (объем газа) по известному количеству другого реагента (продукта)
1. Прокалили 66,6 г минерала малахитCu 2СO 3(OН) 2. Установите объем (в литрах, н.у.) собранного газа.

2. Определите суммарный объем (в литрах, н.у.) газов, полученных при термическом разложении 133,75 г хлорида аммония.
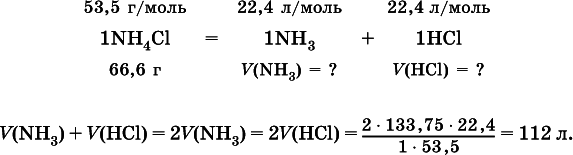
1. Какой объем (в литрах, н.у.) газа выделяется при обработке водой смеси 0,2 моль натрия и 1,4 г лития?
2. При действии избытка воды на 10 г некоторого металла из главной подгруппы II группы выделилось 5,6 (н.у.) газа. О каком металле идет речь?
3. В концентрированный раствор щелочи вносят 2,7 г алюминия. Найдите объем (в литрах, н.у.) собранного газа.
4. На сжигание 0,64 г металла расходуется 12 мл (н.у.) кислорода. Какой металл был взят?
5. Металлическая пластинка массой 50 г после пребывания в соляной кислоте уменьшилась на 1,68 % (по массе), при этом выделилось 0,336 л (н.у.) газа. Из какого металла изготовлена пластинка?
6. При нагревании 139,2 г оксида металла (I) выделилось 6,72 л (н.у.) газа. Оксид какого металла был использован?
7. После обработки равномолярной смеси Mg + Zn избытком едкого натра (конц.) образовалось 4,48 л (н.у.) газа. Рассчитайте массу (в граммах) исходной смеси.
8. Установите объем (в литрах, н.у.) хлора, вступившего в реакцию со щелочью в горячем растворе, если образовалось 0,46 моль хлорид-ионов.
9. Вычислите объем (в литрах, н.у.) полученного газа, если в реакцию с кипящей серной кислотой (конц.) вступило O,5 моль фторида кальция.
10. Сероводород (4,48 л при н.у.) смешали с избытком диоксида серы. Какова масса (в граммах) твердого продукта этой реакции?
11. Поглощение 5,6 л (н.у.) сероводорода раствором нитрата висмута (III) приводит к выпадению осадка средней соли. Найдите массу (в граммах) этого осадка.
12. Раствор гидроксида цезия поглотил 17,92 л (н.у.) диоксида серы с образованием средней соли. Вычислите массу (в граммах) щелочи, истраченной на реакцию.
13. Прокалили 99,3 г нитрата свинца (II). Определите суммарный объем (в литрах, н.у.) полученных газов.
14. В избыток воды внесено 3,75 моль оксида фосфора (V). Какая масса (в граммах) продукта образовалась?
15. Прокаливанием 192 г карбоната аммония получена смесь двух газов и вода. Установите общий объем (в литрах, н.у.) смеси.
16. Внесено 14 г аморфного кремния в концентрированный раствор едкого натра. Рассчитайте объем (в литрах, н.у.) собранного газа.
17. Какой объем в литрах (н.у.) хлора потребуется для получения из метана 4 моль хлороформа?
18. Найдите количество бромэтана (моль), вступившее в реакцию с натрием, если образовалось 237 л (н.у.) органического продукта.
19. Ацетилен обесцвечивает бромную воду с образованием 3,46 г конечного продукта. Определите объем (мл, н.у.) затраченного алкина.
20. Каталитическая реакция дегидрирования 49 г метилциклогексана приводит к получению гомолога бензола. Вычислите объем (в литрах, н.у.) образовавшегося одновременно газа.
21. Этанол с плотностью 0,8 г/мл затрачен на получение 44,8 л (н.у.) дивинила. Установите расход (мл) спирта.
22. На восстановление 10 кмоль этаналя в соответствующий спирт используют водород. Найдите его затраченный объем (м 3, н.у.).
23. Рассчитайте объем (в литрах, н.у.) газа, полученного при спиртовом брожении 5 моль глюкозы.
24. При сгорании природной аминокислоты (с одной группой NH 2в молекуле) в кислороде получена смесь N 2+ СO 2общим объемом 0,56 л (н.у.) и плотностью по водороду 20,4. Определите массу (мг) взятой кислоты.
15.4. Тепловой эффект реакции
Вычислите тепловой эффект (кДж) реакции полной нейтрализации гидроксида натрия серной кислотой, если в расчете на 10 г щелочи выделяется 16,25 кДж теплоты.
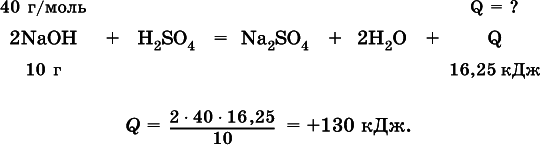
1. В реакции между железом и хлором на 11,2 л (н.у.) окислителя приходится выделение 132 кДж теплоты, следовательно, в расчете на 0,5 моль железа выделится количество теплоты (кДж), равное
1) +198
2) +148,5
3) +99
4) +49,5
2. Триоксид серы массой 280 г вносят в воду, протекает реакция с тепловым эффектом +73 кДж. Количество теплоты (кДж) в условиях опыта равно
1) +204,4
2) +255,5
3) +408,8
4) +511
3. Термическое разложение нитрата калия привело к выделению 4,48 л (н.у.) газа. Тепловой эффект реакции равен -282 кДж, следовательно, сопровождающее процесс количество теплоты (кДж) составляет
1) -56,4
2) -112,8
3) -225,6
4) -282
4. Сожжено 10 л (н.у.) аммиака на воздухе (тепловой эффект реакции +1532 кДж). По условию опыта количество теплоты составит
1) +171
2) +342
3) +766
4) +855
5. Термическое разложение карбоната кальция с тепловым эффектом -179 кДж привело к получению 33,6 г твердого остатка. В этих условиях поглощенное количество теплоты (кДж) равно
1) -537
2) -214,8
3) -375,9
4) -107,4
6. При термическом разложении дихромата аммония протекает экзотермическая реакция, в которой на 1,4 моль образовавшейся воды приходится +106 кДж; следовательно тепловой эффект реакции (кДж) равен:
