Химия. Полный справочник для подготовки к ЕГЭ, стр. 55
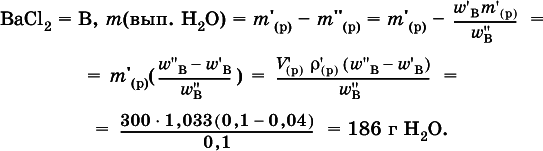
5. Вычислите массу (в граммах) порции гидроксида калия, которую добавили в 400 г 5%-ного раствора этого вещества и довели массовую долю до 40 %.
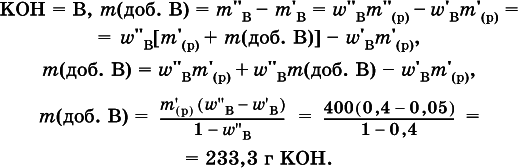
6. Определите массовую долю (в %) серной кислоты в конечном растворе, приготовленным смешиванием 90 г 5%-ного и 120 г 40 %-ного растворов этого вещества.
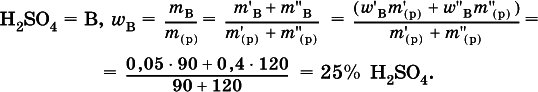
1. Установите массовую долю (в %) хлорида калия в растворе, приготовленным из 0,65 моль соли и 300 мл воды.
2. Приготовлено 300 г 5%-ного раствора иода в этаноле. Рассчитайте массу (в граммах) использованного спирта.
3. Какой объем (в литрах, н. у.) метаналя необходимо растворить в 500 мл воды, чтобы приготовить 30 %-ный формалин.
4. Рассчитайте массовую долю (в %) сульфата цинка (II), если раствор приготовлен из 0,75 моль кристаллогидрата ZnSO 47Н 2O и600 г воды.
5. Найдите массу (в граммах) кристаллогидрата CuSO 45Н 2O, которую необходимо взять для приготовления 160 г 10 %-ного раствора безводной соли.
6. Бромоводород объемом 5,4 л (н. у.) затрачен на приготовление 8 %-ного раствора (плотность равна 1056,8 г/л). Вычислите объем (в литрах) этого раствора.
7. Определите массу (в граммах) добавленной воды, необходимой для приготовления 10 %-ного раствора из 1 моль дигидрата гидроксида калия.
8. Установите массу (в граммах) 4 % – ного раствора нитрата калия, приготовленного путем разбавления водой из 20 г 15 %-ного раствора.
9. Рассчитайте, до какого объема (в литрах) надо разбавить водой 700 г 50,5 %-ного раствора ацетата калия, чтобы приготовить 7,7 %-ный раствор с плотностью 1038 г/л.
10. Какой объем (в литрах) воды необходим для разбавления 200 мл 96 %-ного этанола (плотность 0,8 г/мл) до 10 %-ного спирта?
11. К 100 г 35 %-ного водного раствора метанола добавили 50 г того же вещества. Найдите массовую долю (в %) спирта в конечном растворе.
12. К 250 мл 8% – ного раствора нитрата серебра (I) добавили еще соли и приготовили 16 %-ный раствор. Установите добавленное количество соли (моль).
13. Какой объем (в литрах, н. у.) аммиака надо растворить в 1 л 10 %-ного раствора (плотность 0,96 г/мл) того же вещества для приготовления 15 %-ного раствора?
14. Определите массовую долю (в %) нитрата натрия в конечном растворе, приготовленным смешиванием 90 г 5%-ного и 120 г 40 %-ного растворов.
15. Какую массу в граммах 96 %-ный серной кислоты надо смешать с 200 г 5%-ный кислоты, чтобы приготовить 20 %-ный раствор?
16. Смешали 250 мл 30 %-ного водного раствора метанола (плотность раствора 0,954 г/мл) и 300 г 40 %-ного раствора того же спирта. Какой станет массовая доля (в %) вещества в конечном растворе?
17. Заполнили колбу вначале хлороводородом (н. у.), затем водой. Какова массовая доля (в %) вещества в приготовленном растворе?
18. Гидроортофосфат кальция образует 0,02 %-ный насыщенный раствор в комнатных условиях. Найдите минимальный объем (в литрах) воды, требующийся для растворения 100 г соли.
19. Приготовлен раствор из 219 г кристаллогидрата СаCl 26Н 2O и 1 л воды. Рассчитайте массовую долю (в %) безводной соли в этом растворе.
20. Определите количество гидроксида калия (моль), содержащееся в 3 л 25 %-ного раствора (плотность 1,24 г/мл).
21. Найдите объем (мл) воды, в котором надо растворить 70 г Fe(NO 3) 39Н 2O для приготовления 12 %-ного раствора.
22. Каким количеством воды (моль) надо разбавить 500 мл 20 %-ный азотной кислоты (плотность 1,12 г/мл), чтобы приготовить 8 %-ный раствор?
23. Разбавлением водой приготовлен 1 кг 3,5 %-ный уксусной кислоты из 70 %-ной (плотность 1,069 г/мл). Найдите объем (мл) исходного раствора кислоты.
24. Приготовили раствор 10 г сахарозы в 200 г воды. Затем раствор упарили вдвое (по объему). Определите массовую долю (в %) углевода в конечном растворе.
25. К 1 л 25 %-ного раствора едкого натра (плотность раствора 1,28 г/мл) добавляют порцию той же щелочи и готовят 35 %-ный раствор. Рассчитайте массу (в граммах) этой порции.
26. Смешали 300 мл 10 %-ный хлороводородной кислоты (плотность 1,05 г/мл) и 100 г 5%-ной кислоты. Определите массовую долю (в %) растворенного вещества в конечном растворе.
27. Водный 5 %-ный раствор нитрата стронция массой 320 г смешали с 45 г 38 %-ного раствора того же вещества. Рассчитайте конечную массовую долю (в %) растворенного вещества.
15.2. Объемное отношение газов
Для химической реакции aA + bB = cC + dDвыполняется соотношение
где n Аи n В– количества вступивших в реакциюисходных веществ, п Си n D– количества образовавшихся продуктов, а, b, си d– стехиометрические коэффициенты.
От количеств веществ легко перейти к их массам:
Для газообразных веществ чаще задают или определяют их объемы. Если реагент В и продукт D – газы, то проводят переход от количеств этих веществ к их объемам:
При известных (по условию) количестве, массе или объеме (для газа) одного из веществ, участвующих в реакции, можно рассчитать значения всех величин для остальных веществ.
В случае смеси газов А и В, один из которых участвует в реакции, можно найти взятое соотношение их объемов V A: V B, а при заданном соотношении – объем их смеси (или наоборот).
При высокой температуре магний реагирует с азотом, взятым в виде смеси с аргоном, общим объемом 5,6 л (н.у.), и образует 15 г нитрида. Рассчитайте объемное отношение газов V(N 2): V(Ar) в исходной смеси.
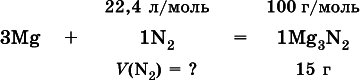
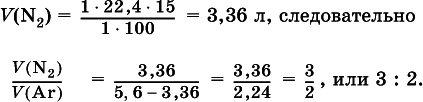
1. Прореагировало 6 л оксида азота (II) с 5 л кислорода (объемы измерены при равных условиях), следовательно, в конечной смеси объемное отношение продукта к одному из реагентов равно
1) 3: 1
2) 2: 1
3) 1: 2
4) 1: 3
2. В замкнутом сосуде сожгли 24 г графита в 67,2 л (н. у.) кислорода и получили объемное отношение кислород: продуктравным
1) 2: 1
2) 1: 1
3) 1: 2
4) 2: 3
3. Пропустили через озонатор 7,5 моль кислорода, который частично превратился в озон. Последний полностью затрачен на «сжигание» (при нормальных условиях) 0,5 моль сероводорода (превращается в SO 2); следовательно, объемное отношение O 3: O 2на выходе из озонатора составляло
1) 1: 12
2) 1: 19
3) 2: 27
4) 2: 33
4. Бромид калия массой 142,8 г прореагировал количественно в растворе с хлором, взятым в виде смеси с воздухом в объемном отношении 1 (хлор): 2 (воздух). Общий объем (в литрах) исходной смеси газов был
