Химия. Полный справочник для подготовки к ЕГЭ, стр. 54
1) 14
2) 10
3) 6
4) 2
3?4. В уравнении реакции
3. Al + V 2O 5> Al 2O 3+ V
4. MgC 2+ Cl 2> MgCl 2+ СCl 4
сумма коэффициентов равна
1) 8
2) 13
3) 18
4) 24
5—6. В уравнении реакции
5. КMnО 4+ Н 2O + K 2SO 4> MnO 2v + K 2SO 4+ KOH
6. KI + H 2O + Cl 2> KIO 3+ HCl
сумма коэффициентов равна
1) 9
2) 10
3) 13
4) 14
7. Укажите соответствие между веществом (формула подчеркнута) и его функцией в реакции.
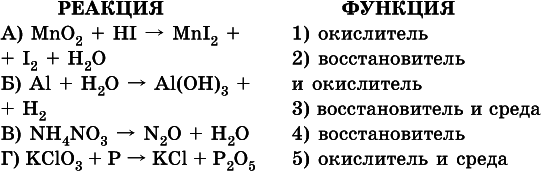
8. При электролизе расплава смеси гидроксида и хлорида калия набор продуктов на электродах – это
1) Н 2, O 2
2) К, O 2
3) K, Cl 2
4) Н 2, Cl 2
9. При электролизе раствора нитрата ртути (II) набор продуктов на электродах – это
1) Hg, O 2
2) H 2, O 2
3) Hg, N 2
4) H 2, N 2
10. Установите соответствие между веществом и продуктом, образующимся на катоде при электролизе раствора

11. Установите соответствие между веществом и продуктом, образующимся на аноде при электролизе раствора

12—14. Используя метод электронного баланса, составьте уравнение реакции по указанной схеме. Определите окислитель и восстановитель.
12. Mn(NO 3) 2+ HNO 3+ РЬO 2 > HMnO 4+ Pb(NO 3) 2+…
13. Zn + H 2SO 4+ HNO 3(разб.) > ZnSO 4+ NO +…
14. K 2Cr 2O 7+ HCl + C 2H 5OH > CrCl 3+ CH 3C(H)O +…
15. Решение расчетных задач
15.1. Массовая доля растворенного вещества. Разбавление, концентрирование и смешивание растворов
Массовая доля растворенного веществаВ
(? в) – это отношение массы вещества В ( т в) к массе раствора ( m (р)):
При решении ? ввыражается всегда в долях единицы (например, ? в =0,01), в ответе – часто в процентах ( ? в=1 %).
Величина, численно равная ? в(в %), характеризует раствор в целом, например, при ? в= 1 % раствор будет однопроцентным(1 %-ный раствор вещества В).
Соотношения для массы раствора:
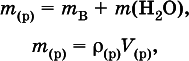
где ? (р)– плотность и V (p)– объем раствора.
Для воды условно считается, что ее масса и объем численноравны, т. е. плотность принимается равной 1 г/мл или 1000 г/л.
Если для приготовления раствора берется кристаллогидрат некоторой соли (а не сама безводная соль), то используются соотношения:
а) масса кристаллогидратаВ хН 2O
где m(кр. Н 2O) – масса воды, которая содержится в данной массе кристаллогидрата;
б) масса безводной солиВ в кристаллогидрате
так как n в= n кр;
б) масса добавляемой воды
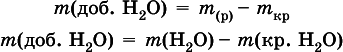
где т(Н 2O) – суммарная масса воды в приготовленном растворе.
В лабораторной практике часто приходится готовить разбавленныйраствор вещества (величины с индексом ') из концентрированногораствора того же вещества (величины с индексом ") путем разбавления водой.
Масса растворенного веществапри разбавлении не изменяется:
Масса добавляемой водыопределяется соотношением:
Для приготовления концентрированного раствора вещества В из разбавленного раствора применяют два способа.
а) Выпариваниенекоторой порции воды из начального раствора. При этом масса растворенного веществане меняется.
а масса воды, которую удаляют из раствора, определяется соотношением:
б) Добавлениенекоторой порции вещества В в начальный раствор. При этом масса водыне изменяется:
а масса добавленного веществаопределяется соотношением
Для приготовления раствора с промежуточным составом(величины без индексов) проводят смешивание концентрированногои разбавленногорастворов вещества В. При этом все величины связаны соотношениями:
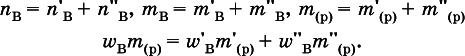
1. Вычислите объем (в литрах, н.у.) аммиака, который полностью поглощается водой с образованием 500 г 20 %-ного раствора.
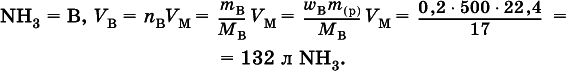
2. Какую массу (в граммах) кристаллогидрата Na 2CO 310Н 2O следует использовать для приготовления 250 г 15 %-ного раствора безводной соли?
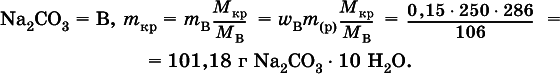
3. До какого объема (в литрах) надо разбавить водой 250 мл 30 %-ного раствора нитрата аммония (плотность раствора 1,13 г/мл), чтобы приготовить 10 %-ный раствор (плотность 1,04 г/мл)?
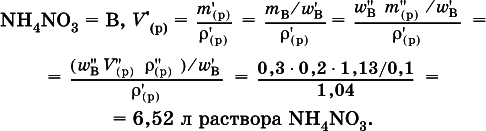
4. Установите массу (в граммах) выпаренной воды из 300 мл 4%-ного раствора хлорида бария (плотность раствора 1033 г/л), если приготовлен 10 %-ный раствор.
