Химия. Полный справочник для подготовки к ЕГЭ, стр. 53
к)
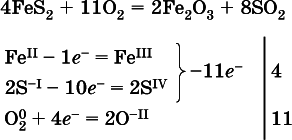
(в FeS 2окисляются атомы Fe IIFe IIIи S -I > S IV, расчет ведут на число этих атомов в формульной единице реагента и суммируют число отданных электронов);
л)
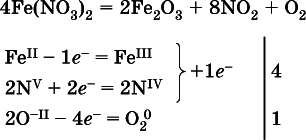
(в реагенте одновременно окисляются атомы первого слева и восстанавливаются атомы второго слева элементов: Fe II > Fe IIIи N V> N IV, расчет ведут на число этих атомов в формуле реагента и алгебраически суммируют число электронов);
м)
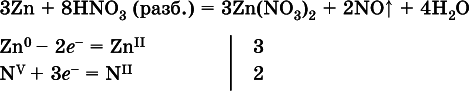
(коэффициент для HNO 3находят суммированием числа атомов N в правой части уравнения);
н)
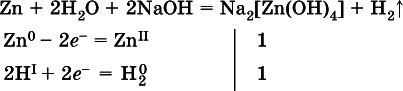
(в раствореZn – восстановитель, H 2O – окислитель; в молекуле воды восстанавливается один атом водорода из двух: Н IОН – Н 0);
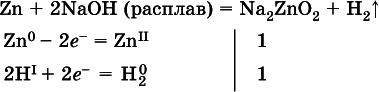
(в расплавевосстанавливается атом водорода из гидроксид-иона [ОН I] - > Н 0).
14.3. Ряд напряжений металлов
В ряду напряжений металлов стрелка отвечает уменьшению восстановительной способности металлов и увеличению окислительной способности их катионов в водном растворе (кислотная среда):
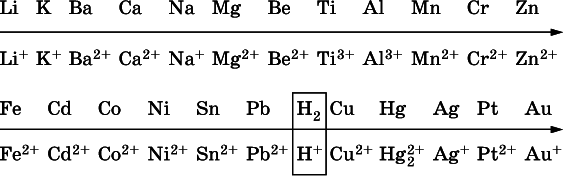
Ряд напряжений позволяет установить:
1) будет ли протекать реакция между металлом и водой; металлы, стоящие в ряду левее Mg, т. е. Li, К, Ва, Са и Na, реагируют с водой по уравнениям:
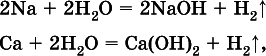
остальные металлы в обычных условиях не реагируют с водой;
2) будет ли протекать реакция с выделением Н 2между металлом и кислотой, которая является окислителем за счет катионов Н +, такими как НCl и H 2SO 4(разб.).
С НCl (разб.) и H 2SO 4(разб.) реагируют почти все металлы, стоящие левееводорода, например:
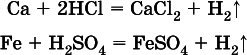
Исключения:металлы Ti и Sn реагируют только с НCl (конц.):
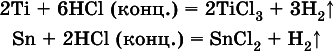
и не реагируют с H 2SO 4(разб.). Металл Pb, восстановительная активность которого почти равна таковой для водорода, не реагирует с НCl (разб., конц.) и H 2SO 4(разб.).
Металлы, стоящие в ряду напряжений правееводорода – Cu, Hg, Ag, Pt и Au, в принципе не вступают во взаимодействие с НCl и H 2SO 4(разб.) и не вытесняют из них водорода.
Внимание!Из распространенных кислот в реакции с вытеснением водорода не вступают азотная кислота HNO 3(ни концентрированная, ни разбавленная) и серная кислота H 2SO 4(конц.);
3) будет ли протекать реакция замещения между металлом и сольюдругого металла в ее растворе; чем левее находится металл в ряду напряжений, тем легче он переходит в состояние катиона и восстанавливает все металлы, стоящие справа от него(положение металлов относительно водорода не имеет значения). Так, Fe вытесняет металлы Cd – Au (по ряду слева направо) из растворов их солей.
Примеры:
а)
б)
в)
В этих реакциях не используют металлы Li – Na (левая часть ряда), которые будут реагировать не с солями других металлов в растворе, а с водой.
14.4. Электролиз расплава и раствора
Электролизом называется окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через растворыили расплавыэлектролитов.
На отрицательно заряженном электроде — катодепроисходит электрохимическое восстановлениечастиц (атомов, молекул, катионов), а на положительно заряженном электроде — анодеидет электрохимическое окислениечастиц (атомов, молекул, анионов).
Примеры электролиза расплавов:
а)
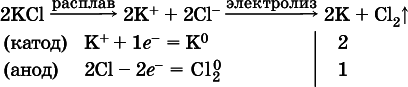
б)
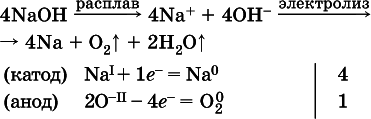
Электролиз водыпроводится всегда в присутствии инертногоэлектролита (для увеличения электропроводности очень слабого электролита – воды):
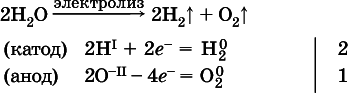
В зависимости от инертного электролита электролиз проводится в нейтральной, кислотной или щелочной среде (например, в присутствии K 2SO 4, H 2SO 4или КОН).
При выборе инертного электролита необходимо учесть, что никогда не восстанавливаются на катоде в водном растворе катионы металлов, являющихся типичными восстановителями (например, Li +, К +, Са 2+, Na +, Mg 2+, Al 3+), и никогда не окисляется на аноде кислород О -IIанионов оксокислот с элементом в высшей степени окисления (например, ClO 4 -, SO 4 2-, NO 3 -, РО 4 3-, CO 3 2-); вместо них окисляется вода.
Примеры электролиза растворов солей:
а)
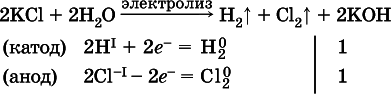
(на аноде окисляются анионы Cl -, а не кислород О -IIмолекул Н 2O, так как электроотрицательность хлора меньше, чем у кислорода, и следовательно, хлор отдает электроны легче, чем кислород);
б)
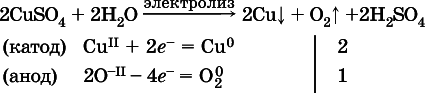
(на катоде восстанавливаются катионы Cu 2+, а не водород Н Iмолекул Н 2O, так как медь стоит правее водорода в ряду напряжений, т. е. легче принимает электроны, чем Н Iв воде; подробнее см. 5.3).
Подчеркнем еще раз, что электролиз – это окислительно-восстановительная реакция, которая протекает под действием и при участии электрического тока. Уравнения электрохимических реакций отражают те процессы, которые без помощи электрического тока протекать не могут.
1. В уравнении реакции
CuS + HNO 3(конц.) > CuSO 4+ NO 2^ +… коэффициент у формулы окислителя равен
1) 1
2) 4
3) 8
4) 11
2. В уравнении реакции
К 2Cr 2O 7+ НCl > CrCl 3+ Cl 2^ +… коэффициент у формулы восстановителя – это
