Химия. Полный справочник для подготовки к ЕГЭ, стр. 49
Кислые соли(большинство из них растворимы в воде) диссоциируют полностью по типу средних солей:
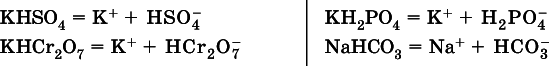
Образующиеся гидроанионы подвергаются, в свою очередь, воздействию воды:
а) если гидроанион принадлежит сильнойкислоте, то он сам диссоциирует также полностью:
и полное уравнение диссоциации запишется в виде:
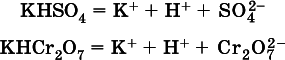
(растворы таких солей обязательно будут кислыми, как и растворы соответствующих кислот);
б) если гидроанион принадлежит слабойкислоте, то его поведение в воде двойственно – либо неполная диссоциация по типу слабой кислоты:
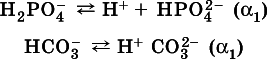
либо взаимодействие с водой (называемое обратимым гидролизом):
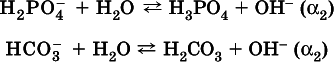
При ? 1> ? 2преобладает диссоциация (и раствор соли будет кислым), а при ? 1> ? 2– гидролиз (и раствор соли будет щелочным). Так, кислыми будут растворы солей с анионами HSO 3 -, H 2PO 4 -, H 2AsO 4 -и HSeO 3 -, растворы солей с другими анионами (их большинство) будут щелочными. Другими словами, название «кислые» для солей с большинством гидроанионов не предполагает, что эти анионы будут вести себя в растворе как кислоты (гидролиз гидроанионов и расчет отношения между ? 1и а 2изучаются только в высшей школе).
Оснoвныесоли MgCl(OH), Cu 2CO 3(OH) 2и другие в своем большинстве практически нерастворимы в воде, и обсуждать их поведение в водном растворе невозможно.
13.3. Диссоциация воды. Среда растворов
Сама вода – это очень слабыйэлектролит:
Концентрации катиона Н +и аниона ОН -в чистой воде весьма малы и составляют 1 10 -7моль/л при 25 °C.
Катион водорода Н +представляет собой простейшее ядро – протон р +(электронная оболочка катиона Н +– пустая, 1s 0). У свободного протона велики подвижность и проникающая способность, в окружении полярных молекул Н 2O он не может оставаться свободным. Протон тут же присоединяется к молекуле воды:
В дальнейшем для простоты оставляется запись Н +(но подразумевается Н 3O +).
В воде содержание ионов Н +и ОН одинаково; в водных растворах кислот появляется избыток ионов Н +, в водных растворах щелочей – избыток ионов ОН (за счет диссоциации кислот и оснований).
Типы среды водных растворов:
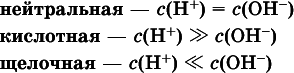
Содержание Н +и ОН -в водных растворах обычно выражают через водородный показательрН (читается пэ-аш) и аналогичный ему гидроксильный показательрОН:
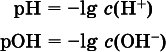
Для воды при комнатной температуре имеем:
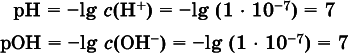
следовательно, в чистой воде:
Это равенство справедливо и для водных растворов:
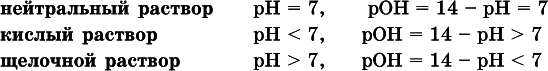
Практическая шкала рН отвечает интервалу 1—13 (разбавленные растворы кислот и оснований):
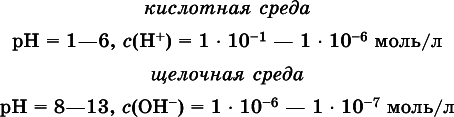
В практически нейтральной среде с рН = 6–7 и рН = 7–8 концентрация Н +и ОН -очень мала (1 10 -6– 1 • 10 -7моль/л) и почти равна концентрации этих ионов в чистой воде. Такие растворы кислот и оснований считаются предельноразбавленными (содержат очень мало вещества).
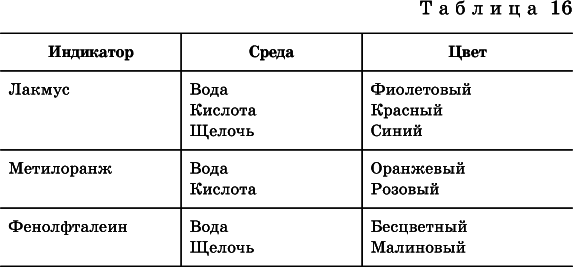
Для практического установления типа среды водных растворов служат индикаторы– вещества, которые окрашивают в характерный цвет нейтральные, кислые и/или щелочные растворы.
Распространенные в лаборатории индикаторы – это лакмус, метилоранж и фенолфталеин.
Метилоранж (индикатор на кислотную среду) становится розовымв сильнокислом растворе (табл. 16), фенолфталеин (индикатор на щелочную среду) – малиновым в сильнощелочном растворе, а лакмус используется во всех средах.
13.4. Реакции ионного обмена
В разбавленных растворах электролитов (кислот, оснований, солей) химические реакции протекают обычно при участии ионов. При этом все элементы реагентов могут сохранять свои степени окисления ( обменные реакции)или изменять их ( окислительно-восстановительные реакции).Примеры, приводимые далее, относятся к обменным реакциям (о протекании окислительно-восстановительных реакций см. разд. 14).
В соответствии с правилом Бертолле, ионные реакции протекают практически необратимо, если образуются твердые малорастворимые вещества(они выпадают в осадок), легколетучие вещества(они выделяются в виде газов) или растворимые вещества – слабые электролиты(в том числе и вода). Ионные реакции изображаются системой уравнений — молекулярным, полными кратким ионным.Ниже полные ионные уравнения опущены (читателю предлагается составить их самому).
При написании уравнений ионных реакций надо обязательно руководствоваться таблицей растворимости (см. табл. 8).
Примерыреакций с выпадением осадков:
а)
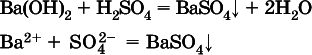
б)
в)
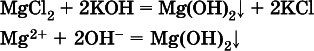
г)
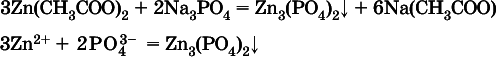
Внимание!Указанные в таблице растворимости (см. табл. 15) малорастворимые («м») и практически нерастворимые («н») соли выпадают в осадок именно в том виде, как они представлены в таблице (СаF 2v, PbI 2v, Ag 2SO 4v, AlPO 4v и т. д.).
В табл. 15 не указаны карбонаты– средние соли с анионом CO 3 2-. Следует иметь в виду, что:
1) К 2СO 3, (NH 4) 2CO 3и Na 2CO 3растворимы в воде;
