Химия. Полный справочник для подготовки к ЕГЭ, стр. 48
По справочным данным составлена таблица растворимостираспространенных кислот, оснований и солей (табл. 15), в которой указан тип растворимости, отмечены вещества, не известные науке (не полученные) или полностью разлагающиеся водой.
Условные обозначения, используемые в таблице:
«р» – хорошо растворимое вещество
«м» – малорастворимое вещество
«н» – практически нерастворимое вещество
«—» – вещество не получено (не существует)
«
» – вещество смешивается с водой неограниченно
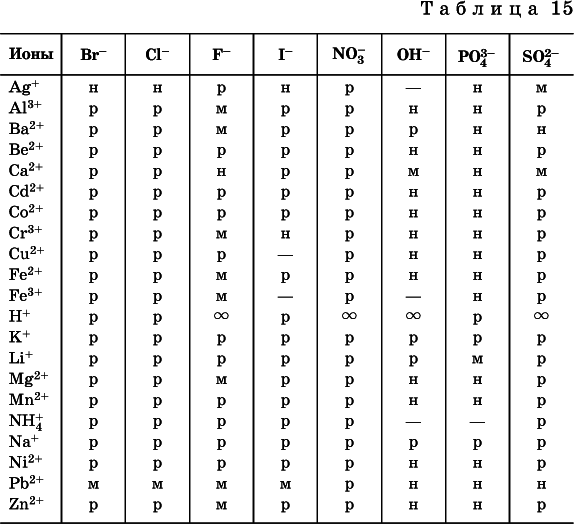
Примечание. Данная таблица отвечает приготовлению насыщенного раствора при комнатной температуре путем внесения вещества (в соответствующем агрегатном состоянии) в воду. Следует учесть, что получение осадков малорастворимых веществ с помощью реакций ионного обмена возможно не всегда (подробнее см. 13.4).
13.2. Электролитическая диссоциация
Растворение любого вещества в воде сопровождается образованием гидратов. Если при этом в растворе не происходит формульных изменений у частиц растворенного вещества, то такие вещества относят к неэлектролитам.Ими являются, например, газ азотN 2, жидкость хлороформСНCl 3, твердое вещество сахарозаC 12Н 22О 11, которые в водном растворе существуют в виде гидратов их молекул.
Известно много веществ (в общем виде МА), которые после растворения в воде и образования гидратов молекул MA nН 2O претерпевают существенные формульные изменения. В результате в растворе появляются гидратированные ионы – катионы М + • nН 2O и анионы А • nН 2O:
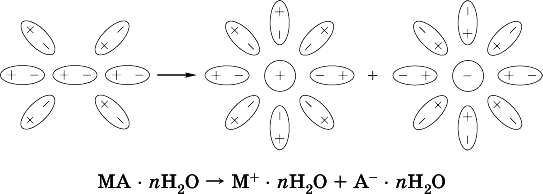
Такие вещества относят к электролитам.
Процесс появления гидратированных ионов в водном раствореназывается электролитической диссоциацией(С. Аррениус, 1887).
Электролитическая диссоциация ионныхкристаллических веществ (М +)(А -) в воде является необратимойреакцией:
Такие вещества относятся к сильным электролитам,ими являются многие основания и соли, например:

Электролитическая диссоциация веществ MA, состоящих из полярныхковалентных молекул, является обратимойреакцией:
Такие вещества относят к слабым электролитам, ими являются многие кислоты и некоторые основания, например:
а)
б)
в)
г)
В разбавленных водных растворах слабых электролитов мы всегда обнаружим как исходные молекулы, так и продукты их диссоциации – гидратированные ионы.
Количественная характеристика диссоциации электролитов называется степенью диссоциациии обозначается ? [1], всегда ? > 0.
Для сильныхэлектролитов ? = 1 по определению (диссоциация таких электролитов полная).
Для слабыхэлектролитов степень диссоциации – отношение молярной концентрации продиссоциировавшего вещества (с д) к общей концентрации вещества в растворе (с):
Степень диссоциации – это доля от единицы или от 100 %. Для слабых электролитов ? « С 1 (100 %).
Для слабых кислотН nА степень диссоциации по каждой следующей ступени резко уменьшается по сравнению с предыдущей:
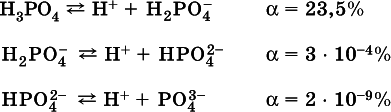
Степень диссоциации зависит от природы и концентрации электролита, а также от температуры раствора; она растет при уменьшенииконцентрации вещества в растворе (т. е. при разбавлении раствора) и при нагревании.
В разбавленныхрастворах сильных кислотН nА их гидроанионы Н n-1А не существуют, например:
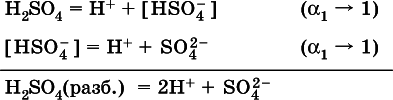
B концентрированныхрастворах содержание гидроанионов (и даже исходных молекул) становится заметным:
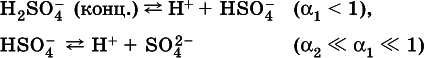
(суммировать уравнения стадий обратимой диссоциации нельзя!). При нагревании значения ? 1и ? 2возрастают, что способствует протеканию реакций с участием концентрированных кислот.
Кислоты – это электролиты, которые при диссоциации поставляют в водный раствор катионы водорода и никаких других положительных ионов не образуют:
Распространенные сильные кислоты:
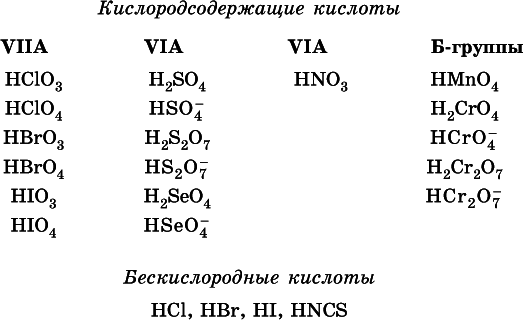
В разбавленном водном растворе (условно до 10 %-ного или 0,1-молярного) эти кислоты диссоциируют полностью. Для сильных кислот Н nА в список вошли их гидроанионы(анионы кислых солей), также диссоциирующие полностью в этих условиях.
Распространенные слабые кислоты:
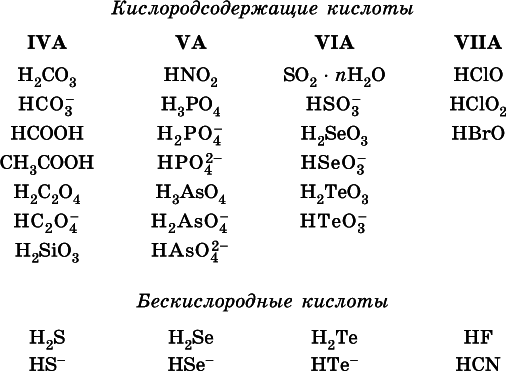
Основания – это электролиты, которые при диссоциации поставляют в водный раствор гидроксид-ионы и никаких других отрицательных ионов не образуют:
Диссоциация малорастворимыхоснований Mg(OH) 2, Cu(OH) 2, Mn(OH) 2, Fe(OH) 2и других практического значения не имеет.
К сильнымоснованиям ( щелочам) относятся NaOH, КОН, Ва(ОН) 2и некоторые другие. Самым известным слабым основанием является гидрат аммиака NH 3Н 2O.
Средние соли – это электролиты, которые при диссоциации поставляют в водный раствор любые катионы, кроме Н +, и любые анионы, кроме ОН -:
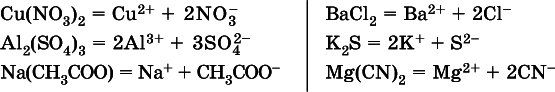
Речь идет только о хорошо растворимых солях. Диссоциация малорастворимыхи практически нерастворимыхсолей значения не имеет.
Аналогично диссоциируют двойные соли:
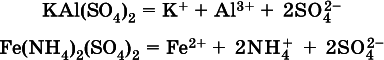
1
Буквой ? (альфа) обозначают степень протекания любых обратимых реакций, в том числе и степень гидролиза солей (см. 13.5)
