Химия. Полный справочник для подготовки к ЕГЭ, стр. 4
Известен еще один вид связи, называемой металлической связью,в которой валентные электроны так непрочно удерживаются атомами металлов, что фактически не принадлежат конкретным атомам.
Атомы металлов, оставшиеся без четко принадлежащих им внешних электронов, становятся как бы положительными ионами. Они образуют металлическую кристаллическую решетку.Совокупность обобществленных валентных электронов ( электронный газ)удерживает положительные ионы металла вместе и в определенных узлах решетки.
Помимо ионных и металлических кристаллов существуют еще атомныеи молекулярныекристаллические вещества, в узлах решеток которых находятся атомы или молекулы соответственно. Примеры: алмаз и графит – кристаллы с атомной решеткой, иод I 2и диоксид углерода СO 2(сухой лед) – кристаллы с молекулярной решеткой.
Химические связи существуют не только внутри молекул веществ, но могут образовываться и между молекулами, например для жидкого HF, воды Н 2O и смеси H 2O + NH 3:
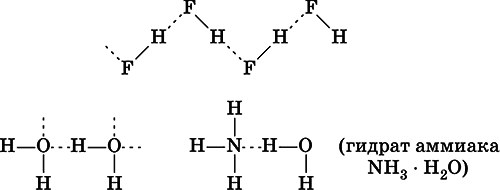
Водородная связьобразуется за счет сил электростатического притяжения полярных молекул, содержащих атомы самых электроотрицательных элементов – F, О, N. Например, водородные связи имеются в HF, Н 2O и NH 3, но их нет в HCl, H 2S и РН 3.
Водородные связи малоустойчивы и разрываются довольно легко, например при плавлении льда и кипении воды. Однако на разрыв этих связей затрачивается некоторая дополнительная энергия, и поэтому температуры плавления (табл. 5) и кипения веществ с водородными связями

(например, HF и Н 2O) оказываются значительно выше, чем у подобных веществ, но без водородных связей (например, HCl и H 2S соответственно).
Многие органические соединения также образуют водородные связи; важную роль водородная связь играет в биологических процессах.
1. Вещества только с ковалентными связями – это
1) SiH 4, Сl 2O, СаВr 2
2) NF 3, NH 4Cl, P 2O 5
3) CH 4, HNO 3, Na(CH 3O)
4) CCl 2O, I 2, N 2O
2–4.Ковалентная связь
2. одинарная
3. двойная
4. тройная
присутствует в веществе
1) КСl
2) N 2
3) S 2
4) H 2S
5. Кратные связи имеются в молекулах
1) HCOOH
2) ССl 4
3) С 3Н 8
4) С 3Н 4
6. Частицы, называемые радикалами, – это
1) SO 2
2) СlO 2
3) С 2Н 6
4) С 2Н 5
7. Одна из связей образована по донорно-акцепторному механизму в наборе ионов
1) SO 4 2-, NH 4 +
2) H 3O +, NH 4 +
3) PO 4 3-, NO 3 -
4) PH 4 +, SO 3 2-
8. Наиболее прочнаяи короткаясвязь – в молекуле
1) Н 2O
2) H 2S
3) HF
4) PH 3
9. Вещества только с ионными связями – в наборе
1) HCl, КСl
2) NH 4Cl, SiCl 4
3) NaF, CsCl
4) Nal, P 2O 5
10–13.Кристаллическая решетка вещества
10. Si
11. H 2SO 4
12. Cr
13. Ва(ОН) 2
1) металлическая
2) ионная
3) атомная
4) молекулярная
4. Классификация и взаимосвязь неорганических веществ
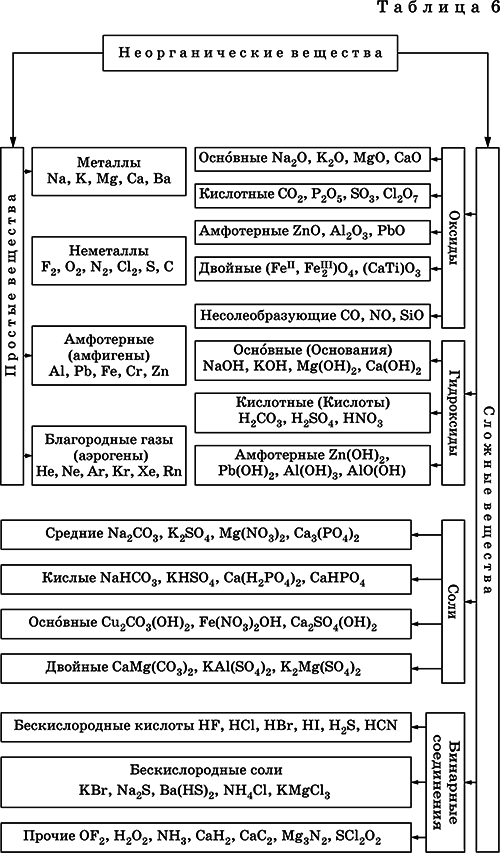
Классификация неорганических веществ базируется на химическом составе– наиболее простой и постоянной во времени характеристике. Химический состав вещества показывает, какие элементы присутствуют в нем и в каком числовом отношении для их атомов.
Элементыусловно делятся на элементы с металлическими и неметаллическими свойствами. Первые из них всегда входят в состав катионовмногоэлементных веществ (металлическиесвойства), вторые – в состав анионов (неметаллическиесвойства). В соответствии с Периодическим законом в периодах и группах между этими элементами находятся амфотерные элементы, проявляющие одновременно в той или иной мере металлические и неметаллические (амфотерные,двойственные) свойства. Элементы VIIIA-группы продолжают рассматривать отдельно (благородные газы),хотя для Kr, Хе и Rn обнаружены явно неметаллические свойства (элементы Не, Ne, Ar химически инертны).
Классификация простых и сложных неорганических веществ приведена в табл. 6.
Ниже приводятся определения (дефиниции) классов неорганических веществ, их важнейшие химические свойства и способы получения.
Неорганические вещества– соединения, образуемые всеми химическими элементами (кроме большинства органических соединений углерода). Делятся по химическому составу:
Простые веществаобразованы атомами одного элемента. Делятся по химическим свойствам:

Металлы– простые вещества элементов с металлическими свойствами (низкая электроотрицательность). Типичные металлы:
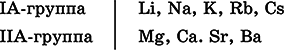
Металлы обладают высокой восстановительной способностью по сравнению с типичными неметаллами. В электрохимическом ряду напряжений они стоят значительно левее водорода, вытесняют водород из воды (магний – при кипячении):
Простые вещества элементов Cu, Ag и Ni также относят к металлам, так как у их оксидов CuO, Ag 2O, NiO и гидроксидов Cu(OH) 2, Ni(OH) 2преобладают основные свойства.
Неметаллы– простые вещества элементов с неметаллическими свойствами (высокая электроотрицательность). Типичные неметаллы: F 2, Cl 2, Br 2, I 2, O 2, S, N 2, Р, С, Si.
Неметаллы обладают высокой окислительной способностью по сравнению с типичными металлами.
Амфигены– амфотерные простые вещества, образованные элементами с амфотерными (двойственными) свойствами (электроотрицательность промежуточная между металлами и неметаллами). Типичные амфигены: Be, Cr, Zn, Аl, Sn, Pb.
Амфигены обладают более низкой восстановительной способностью по сравнению с типичными металлами. В электрохимическом ряду напряжений они примыкают слева к водороду или стоят за ним справа.
Аэрогены– благородные газы, одноатомные простые вещества элементов VIIIA-группы: Не, Ne, Ar, Kr, Xe, Rn. Из них He, Ne и Ar химически пассивны (соединения с другими элементами не получены), а Kr, Хе и Rn проявляют некоторые свойства неметаллов с высокой электроотрицательностью.
