Химия. Полный справочник для подготовки к ЕГЭ, стр. 37
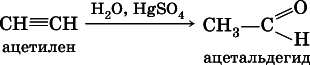
г) реакция Кучерова(гидратация на катализаторе)
При циклизацииацетилена образуется бензол:
Упомянутый выше хлорвинил способен полимеризоваться:
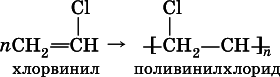
Поливинилхлорид (ПВХ) – полимер, основа пластмассы, волокон и пленок, применяется в производстве труб, искусственной кожи, электроизоляции, пеноматериалов.
Качественные реакции:
1) на алкины любого строения – обесцвечивание раствора КMnO 4, чаще всего происходит разрыв углеродной цепи по месту тройной связи (ср. с алкенами);
2) на алкины с концевой тройной связью – замещение концевого атома водорода на медь (I) с образованием ярко-красного осадка:
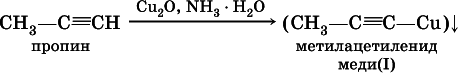
Получение:в промышленностиацетилен ранее получали гидролизом дикарбида (ацетиленида) кальция:
(неприятный «карбидный» запах газа обусловлен примесями, главным образом фосфином РН 3).
Современный способ — пиролиз(термическое разложение) метана:
В лабораториидля получения ацетилена и его гомологов используют взаимодействие дигалогенопроизводных алканов со щелочами в спиртовом растворе при нагревании:
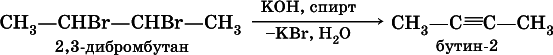
(обязательное условие – атомы галогенов должны находиться при соседних атомах углерода). Эта реакция может проходить в одну стадию (как показано выше), но чаще – в две стадии:
а)
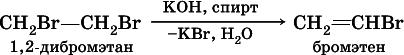
б)
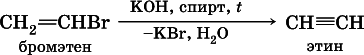
Алкины, особенно ацетилен, используются как исходное сырье в химической промышленности для многих органических синтезов. Кроме того, ацетилен благодаря высокой теплотворной способности сгорания:
применяется для автогенной сварки и резки металлов.
9.4. Арены
Арены – это непредельные углеводороды, которые можно рассматривать как производные простейшего из них — бензолаС 6Н 6. Общая формула углеводородов гомологического ряда бензола С nН 2n- 6(при n ? 6).
В молекуле бензола все атомы углерода находятся в sр 2-гибридизации, каждый атом углерода соединен в одной плоскости?-связями с двумя другими атомами углерода и одним атомом водорода. У атома углерода остается еще облако четвертого валентного электрона, расположенное перпендикулярноплоскости. Эти облака участвуют в образовании ?-связи, причем в молекуле образуются не три отдельные ?-связи (как думали раньше, см. формулу Кекуле, 1865 г.), а единая шестицентровая (С 6) ?-связь (все атомы равноценны):
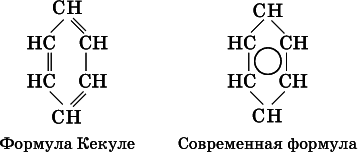
Формула Кекуле часто применяется в тех случаях, когда необходимо более наглядно представить протекание реакции с участием бензольного кольцаС 6; его изображение:
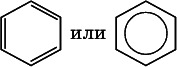
В обеих формулах атомы С кольца и не участвующие в реакции атомы Н опускаются (для краткости). Некоторые простейшие гомологи бензола:
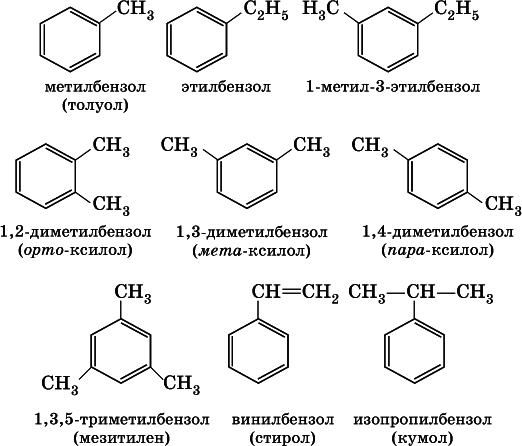
Радикал бензола С 6Н 5называется фенил,радикал толуола С 6Н 5СН 2— бензил.
Бензол и его ближайшие гомологи – жидкости без цвета, но с характерным запахом, имеют широкий интервал жидкого состояния. Практически не растворяются в воде, но хорошо смешиваются между собой и с другими органическими растворителями. Пар бензола сильно ядовит.
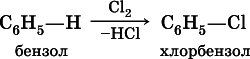
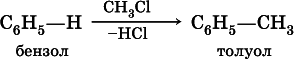
Несмотря на формальную непредельность, бензол отличается высокой устойчивостью к нагреванию и окислению (в гомологах бензола окисляется только боковая цепь). Характерными для бензола являются реакции замещения:
а) нитрованиев присутствии концентрированной серной кислоты на холоду:
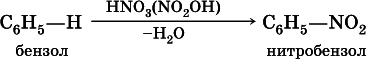
б) галогенированиев присутствии галогенидов железа (III):
в) алкилированиев присутствии хлорида алюминия:
Особый характер ненасыщенности бензола и его гомологов иллюстрируется этими химическими свойствами и называется «ароматическим» характером.
В производных бензола атом или группа, заместившие водород кольца, и само бензольное кольцо влияют друг на друга. По характеру влияния различают:
1) заместители I рода – CI, Br, I, СН 3, С nН 2n+1, ОН и NH 2. Они облегчают реакции дальнейшего замещения и направляют второй заместитель по отношению к себе в орто-(о-, или 2-) положение и в пара-( п-, или 4-) положение [для запоминания: орто – около, пара – против], например:
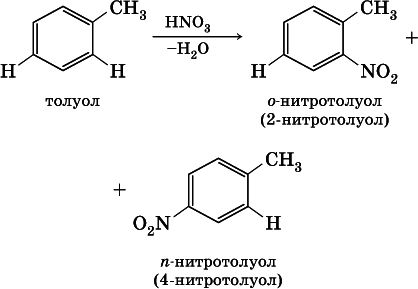
2) заместители II рода – NO 2, С(Н)O, СООН и CN. Они затрудняют реакции дальнейшего замещения и направляют второй заместитель в мета-( м-, или 3-) положение, например:
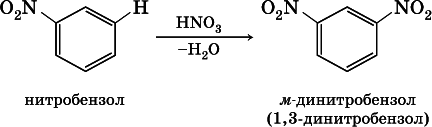
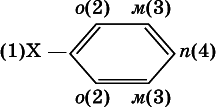
Очевидно, что существуют два орто-положения рядом с первым заместителем X, два мета-положения, отделенные от первого заместителя одним углеродом кольца, и лишь одно пара-положение через два атома углерода бензольного кольца:
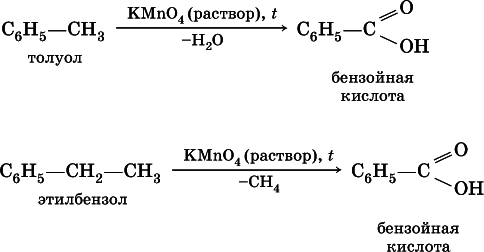
Ранее уже отмечалось, что бензол стоек к окислению даже при действии сильных окислителей. Гомологи бензола с одним боковым радикалом вступают в реакции окислениятолько за счет радикала; при этом, какова бы ни была его длина, отщепляется вся цепь, кроме ближайшего к кольцу атома углерода (он создает карбоксильную группу):
В жестких условиях бензол вступает в реакции присоединения:
