Удивительная палеонтология. История земли и жизни на ней, стр. 16
Дополнение к главе 4
Термодинамические подходы к сущности жизни. Второе начало термодинамики, энтропия и диссипативные структуры.
Нам придется начать издалека. В 1847 году Г. Гельмгольц сформулировал закон сохранения энергии (ЗСЭ). Следует помнить, что ЗСЭ является всего лишь эмпирическим обобщением: вообще говоря, никто не знает, почему энергию нельзя ни сотворить из ничего, ни уничтожить – просто этого не происходит ни в каких (сколь угодно хитроумных) наблюдениях и экспериментах. Однажды ЗСЭ основательно пошатнулся – когда возникла необходимость объяснить, отчего светит Солнце (см. главу 1), однако тут подоспело открытие Эйнштейном эквивалентности массы и энергии, и все опять встало на свои места. Именно поэтому ни одно патентное бюро не станет рассматривать проект устройства для получения бо?льшей энергии, чем оно потребляет; такое устройство получило название вечный двигатель первого рода.
Первой машиной для превращения тепла в механическую энергию стал паровой двигатель. Это устройство производит работу путем перемещения энергии в форме тепла из горячего резервуара (с паром) в холодный резервуар (с водой). Поэтому раздел физики, занимающийся взаимными превращениями работы и энергии, назвали термодинамикой, а паровой двигатель очень долго оставался его основной моделью. Первое начало термодинамики можно выразить так: если резервуар с паром содержит некоторое количество энергии, то от паровой машины нельзя получить больше работы, чем допускает запас этой энергии. Мы видим, что оно является одной из формулировок ЗСЭ.
Согласно первому началу термодинамики, создать вечный двигатель первого рода нельзя. Ну а всю работу, что содержится в паре, мы можем извлечь? (Имеется в виду: если полностью устранить трение и всякие иные потери.) Увы, оказывается, нет. Даже в идеальном случае нельзя не то что выиграть, а хотя бы «получить свое». В 1824 году С. Карно установил, что доля тепловой энергии, которая может быть (даже в идеале!) превращена в работу, зависит от разности температур горячего и холодного резервуаров. Максимально возможный КПД (идеальная отдача) определяется так:
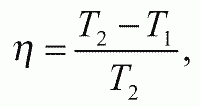
где Т1 и Т2 – температура холодного и горячего резервуаров (в градусах абсолютной шкалы Кельвина).
Пусть, например, Т2 = 400 К (= 127°С), а Т1 = 300 К (= 27°С). В этом случае ? = (400 – 300) / 400 = 0,25. Значит, даже в этом идеализированном случае лишь четверть энергии сможет быть превращена в работу, а остальные три четверти бесполезно пропадут.
Если же у нас имеется только один резервуар (он горячий и он же холодный), то идеальная отдача будет равна нулю: энергии-то в этом резервуаре с паром сколько угодно, но никакая часть ее не может быть превращена в работу. Все это полностью относится и к другим видам энергии. Например, работа, которую может совершить камень, падающий с края обрыва, зависит от высоты последнего (т.е. от разности потенциальных энергий камня), однако камень, лежащий посреди плоскогорья на высоте 5 км, никакой работы совершить не может. В этом и состоит одна из формулировок второго начала термодинамики (ВНТ): ни одно устройство не может извлечь работу из системы, которая целиком находится на одном потенциальном уровне.
Устройство, предназначенное для извлечения работы из системы, имеющей единственный энергетический уровень (и, соответственно, нарушающее ВНТ), называется вечным двигателем второго рода. Представляете, как было бы здорово – откачать, например, энергию теплового движения молекул кастрюльки с водой (кастрюлька-то пусть при этом замерзнет – закон сохранения энергии мы чтим!) и перевести ее в механическую, электрическую или еще какую-нибудь путную форму. Но ничего из этой затеи не выйдет. Вечный двигатель второго рода невозможен точно так же, как и первого.
Как только в системе появляются два энергетических уровня, энергия тут же начинает перетекать от более высокого уровня к низкому: тепло переходит от горячего тела к холодному, камень падает с обрыва, ток начинает течь от анода к катоду и т.д. (поэтому существует и другая формулировка ВНТ: поток энергии всегда направлен от высокого потенциального уровня к низкому). В случае, если наша паровая машина представляет собой замкнутую систему (т.е. никакое вещество и энергия не могут ни проникнуть в нее извне, ни покинуть ее), горячий резервуар будет постепенно остывать, а холодный – нагреваться, т.е. в течение всего времени, пока в системе совершается работа, разность температур резервуаров будет неуклонно падать. Тогда, в соответствии с соотношением Карно, доля содержащейся в системе энергии, которую можно обратить в работу, будет уменьшаться, а доля той «омертвленной» энергии, что недоступна для такого превращения, – необратимо расти. Поэтому ВНТ может быть сформулировано еще и так: в любом самопроизвольном процессе (когда энергии открыт путь для перетекания с более высокого уровня на низкий) количество недоступной энергии со временем увеличивается.
В 1865 году Р. Клаузиус, имея дело с этой самой необратимо теряемой (диссипированной) энергией, ввел специальную величину, названную им энтропией (S); она отражает отношение тепловой энергии к температуре и имеет размерность кал/град. В любом процессе, связанном с превращениями энергии, энтропия возрастает или – в идеальном случае (горячий и холодный резервуары разделены абсолютным теплоизолятором, ток течет по сверхпроводнику и т.д.) – не уменьшается. Поэтому ВНТ иногда называют законом неубывания энтропии. А самая краткая объединенная формулировка первого и второго начал термодинамики, предложенная тем же Клаузиусом (1865), звучит так: в любой замкнутой системе полная энергия остается постоянной, а полная энтропия с течением времени возрастает.
Пусть у нас есть та же пара резервуаров – горячий и холодный. Эти резервуары соединяют, в результате чего их температуры (отражающие среднюю кинетическую энергию молекул) уравниваются. Можно описать эту картину и так: система вначале была структурирована – поделена на горячую и холодную части, а затем эта структура разрушилась; система перешла из упорядоченного состояния в беспорядочное, хаотическое. Понятиям «порядок» и «хаос» не так-то просто дать строгие определения, однако интуитивно мы подразумеваем, что порядок – это когда предметы разложены в соответствии с некой логической системой, а хаос – когда никакой системы не обнаруживается. Итак, мы видим, что когда энергия (в данном случае тепловая) перетекает в направлении, указанном ВНТ, хаос (беспорядок) в системе возрастает. А поскольку энтропия при этом растет тоже, то возникает вполне логичное предположение: а не являются ли «хаос» и «энтропия» родственными, взаимосвязанными понятиями? Так оно и есть. В 1872 году Л. Больцман строго доказал, что клаузиусова энтропия (S) действительно является мерой неупорядоченности состояния системы: S = k ln P, где k – универсальная постоянная Больцмана (3,29 · 10–24кал/град), а P – количественное выражение неупорядоченности (оно определяется довольно сложным способом, который для нас сейчас неважен). Это соотношение называют принципом порядка Больцмана; оно означает, что необратимые термодинамические изменения системы всегда идут в сторону более вероятных ее состояний и в конечном счете ведут к состоянию хаоса – максимальной выравненности и симметрии.
Поскольку в любой замкнутой системе энтропия непрерывно и необратимо возрастает, то со временем в такой системе, как наша Вселенная, исчезнет всякая структурированность и должен воцариться хаос. В частности, установится единая температура (которая, соответственно, будет лишь немногим выше абсолютного нуля). Такую гипотетическую ситуацию называют «тепловой смертью Вселенной». Рассуждения на эту тему были очень модны в конце XIX века. Надо сказать, что закон неубывания энтропии – со всеми его глобально-пессимистическими следствиями – вообще создает массу неудобств для мироощущения любого нормального человека. Неудивительно, что регулярно возникает вопрос: а нельзя ли найти способ как-нибудь «обмануть» ВНТ и победить возрастание энтропии?
